五氮阳离子
五氮阳离子是一种5个氮原子组成的氮原子簇离子,化学式为N+
5。
| 五氮阳离子 | |
|---|---|
 | |
| 别名 | 氮5 |
| 识别 | |
| CAS号 | 12596-65-5 236412-64-9 |
| SMILES |
|
| 性质 | |
| 化学式 | N+ 5 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
历史
美国空军从1986年开始的高能量密度物质研究项目,从1998年开始尝试系统地研究氮原子簇化合物。当位于爱德华兹空军基地的美国空军研究实验室开始对替代有毒的肼类火箭燃料感兴趣时,同时为几个这类计划拨款。美国空军研究实验室的高级研究员Karl O. Christe尝试通过N
2F+
和N−
3制备直线型的N+
5离子,这个方案的理论依据是推测的五氮阳离子的结构[1]:
- [F-N≡N]+ + HN=N=N → [N≡N-N=N=N]+ + HF
1999年时这个反应成功实现了,并制得了足量的N+
5AsF−
6,因此才可以使用核磁共振、红外光谱、拉曼光谱研究其特性。[2] 这种盐极易爆炸,但是当AsF
5被更强的路易斯酸SbF
5替换时,可以制得更加稳定的盐N+
5SbF−
6,对震动不敏感,在60-70°C以下能稳定存在。这使得这类化合物可以较大量地制备、更容易处理,也使得X射线晶体结构分析成为可能。[3]
制法
在-78°C的低温下,用N
2F+
与HN
3在干燥的HF中反应,这也是已知的唯一制法:
- 顺-N
2F
2 + SbF
5 → N
2F+
SbF6− - N
2F+
SbF6−
+ HN
3 → N+
5SbF−
6 + HF
化学性质
N+
5能氧化水、NO、NO
2和Br
2,但不能氧化Cl
2和O
2。它的电子亲和能为10.44 eV (1018.4 kJ/mol)。因此,N+
5必须在干燥的环境中制备和处理:
- 4N+
5AsF−
6 + H
2O → 4HF + 4AsF
5 + 10N
2 + O
2 - 2N+
5SbF−
6 + 2Br
2 → 2Br+
2SbF−
6 + 5N
2
由于氟锑酸盐较稳定,它被用于制备所有其他已知的盐,通常在非水溶剂比如HF、SO
2、CHF
3或CH
3CN中进行复分解反应来实现,因为这时氟锑酸盐是难溶的:
- 2N+
5SbF−
6 + A+
B−
→ N+
5B−
+ ASbF
6
含有N+
5的最稳定的盐加热到50 - 60°C时会分解:N+
5SbF−
6、N+
5SnF−
5和N
5B(CF
3)
4。而最不稳定的盐也已经制得并进行研究:N+
5[P(N
3)−
6]和N+
5[B(N
3)−
4]对震动极敏感,在室温下就可能爆炸,即使稀释到0.5 mmol也会爆炸。有许多种N+
5的盐不能形成,比如氟化物、叠氮化物、硝酸盐和高氯酸盐。[1]
结构与成键
- [N≡N+-N--N+≡N]+
 [N-=N+=N-N+≡N]+
[N-=N+=N-N+≡N]+  [N≡N+-N=N+=N-]+
[N≡N+-N=N+=N-]+  [N+=N-N--N=N+]+
[N+=N-N--N=N+]+  [N+=N-N--N+≡N]+
[N+=N-N--N+≡N]+  [N≡N+-N--N=N+]+
[N≡N+-N--N=N+]+
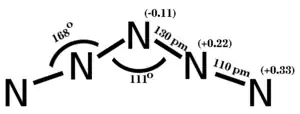
根据量子化学从头计算和X射线实验的结果,这种离子中所有原子共面,空间构型为V形,中心氮原子的键角为111°(N2-N3-N4的夹角),而第二和第四个氮原子的键角为168°(N1-N2-N3和N3-N4-N5的夹角)。N1-N2和N4-N5的键长都是1.10Å,而N2-N3和N3-N4的键长都是1.30Å。[3]
参考资料
- Christe, Karl O. . Propellants, Explosives, Pyrotechnics. 14 Jun 2007, 32 (3): 194–204. doi:10.1002/prep.200700020.
- Christe, Karl O.; William W. Wilson, Jeffrey A. Sheehy, Jerry A. Boatz. . Angewandte Chemie International Edition. 12 Jul 1999, 38 (13-14): 2004–2009. doi:10.1002/(SICI)1521-3773(19990712)38:13/14<2004::AID-ANIE2004>3.0.CO;2-7.
- Vij, Ashwani; William W. Wilson, Vandana Vij, Fook S. Tham, Jeffrey A. Sheehy, Karl O. Christe. . J.Am.Chem.Soc. 9 Jun 2001, 123 (26): 6308–6313. PMID 11427055. doi:10.1021/ja010141g.