价键理论
价键理论(Valence bond theory,VB理论)是一种获得薛定谔方程近似解的处理方法,又称为电子配对法。价键理论与分子轨道理论是研究分子体系的两种量子力学方法。它是历史上最早发展起来的处理多个化学键分子的量子力学理论。价键理论主要描述分子中的共价键及共价结合,核心思想是电子配对形成定域化学键。
发展历史
价键理论的优势
因为价键理论更加清楚的物理意义,所以广为实验化学家,尤其是有机化学家所青睐,并基于价键理论开发出大量定性方法,对理解化学反应起到非常重要的作用。然而,实践证明利用分子轨道理论的数学结构比较简单,进行量子化学计算比价键理论方法容易。
改进
这种局面在20世纪末与21世纪初发生了一定的变化。现代价键理论采用原子轨道线性组合产生价键轨道的方法,可以达到和分子轨道理论方法相似的精度。
现况
然而,由于价键轨道的非正交性等原因,价键理论的数学结构依然比分子轨道理论复杂得多,程序比较少,而相同精度的计算往往需要更多计算资源,所以价键理论目前仍然不太常用。
基本概念
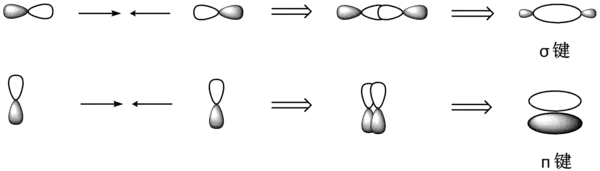
其量子化学模型认为,共价键是由不同原子的电子雲重叠形成的。例如,p軌域的电子和p軌域的电子間可以有两种基本的成键方式:
用形象的言语来描述,σ键是两个原子轨道“头碰头”重叠形成的;π键是两个原子轨道“肩并肩”重叠形成的。一般而言,如果原子之间只有1对电子,形成的共价键是单键,通常是σ键;如果原子间的共价键是双键,由一个σ键和一个π键组成;如果是叁键,则由一个σ键和两个π键组成。σ键可以是s-s,s-p,p-p等电子之间形成的,而π键可由p-p,d-p,d-d等电子之间形成的。除此之外,还存在十分多样的共价键类型,如苯环的p-p大π键,硫酸根的d-p大π键,硼烷中的多中心键,π酸配合物中的反馈键,Re2Cl82−中的δ键,等等。
轨道杂化
价键理论中,为了解释分子或离子的立体结构,莱纳斯·鲍林以量子力学为基础提出了杂化轨道理论。其核心思想即是不同原子轨道的叠加重组,从而成为数目相同,能量相等的新轨道。例如,为了解释甲烷的正四面体结构,杂化轨道理论认为:
碳基态原子构型为1s22s22p2。首先碳2s中的一个电子被激发到空的2p轨道上,然后1个s轨道和3个p轨道重新组合成4个sp3杂化轨道,再分别和4个氢原子的1s电子成键。4个杂化轨道呈正四面体构型,键角109o28',能量没有任何差别。
sp2和sp杂化轨道亦然。
主要的杂化类型和立体构型列于下表:
| 杂化类型 | sp3 | sp2 | sp | sp3d或dsp3 | sp3d2或d2sp3 |
| 立体构型 | 正四面体 | 正三角形 | 直线形 | 三角双锥体 | 正八面体 |
| VSEPR模型 | AY4 | AY3 | AY2 | AY5 | AY6 |
参考资料
- 北京师范大学、华中师范大学、南京师范大学无机化学教研室编。《无机化学》第四版上册。 北京:高等教育出版社。ISBN 7-04-010768-6