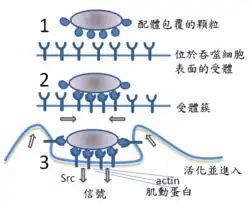
吞噬作用
吞噬作用(英語:,来自古希腊语)亦称吞食、噬菌作用,是吞噬细胞和原生动物通过细胞膜从周围环境摄取固体颗粒,并在其内部形成吞噬体的过程。
吞噬作用是细胞内吞作用的特殊形式,是将周围环境中的固体颗粒例如细菌等通过小泡的形式吞食进入细胞内部,这点与吞饮外部液体的胞饮作用等内吞作用的其他形式相区分。对于一些细胞而言,吞噬作用是为了获取营养物质,而在免疫系统中,这一细胞机制更多地用于清理病原体和细胞碎片等。细菌、死亡的组织细胞以及矿物质微粒都可以成为被吞噬的对象。
对于单细胞生物而言,吞噬作用与进食活动是同源的,而对于除丝盘虫以外的多细胞生物而言,这一机制更多地服务于细胞碎片与病原体的清理,而非为细胞活动提供能量。
歷史
吞噬作用首先由加拿大醫生威廉·奧斯勒(1876)注意到,後來由伊利亞·梅契尼可夫(1880,1883)研究並命名。
免疫系统中的吞噬作用

哺乳类动物免疫细胞的吞噬作用是通过附着在病原相关分子模式()而启动的,并可以激活信号通路。例如和抗体等调理素可以作为附着点,并辅助吞噬细胞进行吞噬作用[1]。
对外部颗粒的吞噬过程由肌凝蛋白-肌动蛋白收缩系统辅助完成,包裹有被吞噬颗粒的吞噬体之后会与溶酶体相融合,并逐渐降解。
降解过程可分为赖氧型和非赖氧型两类:
细胞凋亡中的吞噬作用
在细胞凋亡过程中,凋亡的细胞需要由巨噬细胞通过胞葬作用[註 1],使其被周围组织吸收。凋亡细胞的一明显特征是其细胞内的分子外翻到细胞外表面,例如钙网织蛋白、磷脂丝氨酸、膜联蛋白和氧化低密度脂蛋白等,这些分子会被巨噬细胞表面的特定受体所识别,抑或被一些可溶性受体[註 2](例如血小板反应蛋白1等)识别,而这些可溶性受体本身又与巨噬细胞表面的受体(例如受体)相连。
胞葬作用[註 1]的失效会导致凋亡的细胞无法被正常清除,这通常情况下与巨噬细胞的吞噬作用机制受损有关,不断积累的凋亡细胞会导致自體免疫的紊乱,因此药理学上一般采用增强细胞吞噬作用的方法来治疗一些自體免疫紊乱[4][5][6][7]。
原生生物的吞噬作用
对于很多原生生物,细胞吞噬是一种从外界获取其所需部分或者全部营养物质的途径,这种途径叫做吞噬营养型,与渗透营养型相区分,后者是通过吸收而非吞噬的方法获取营养物质。
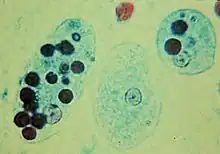
- 一些原生生物,例如变形虫,会伸出伪足来从周围环境中吞噬目标颗粒,这与其它动物体内的吞噬细胞类似。在人体中,溶组织内阿米巴()可以吞噬红血球[8],这一过程也被称为噬红细胞作用,也是唯一被认可的用于区别溶组织内阿米巴与其它非侵害型的内阿米巴属生物(例如)的方法[9]。
- 纤毛虫也能够进行吞噬作用[10]。在纤毛虫口沟末端存在一个椭圆形小孔,在这里会发生吞噬作用,这个结构通常被叫做胞口或口。
通过吞噬作用产生的吞噬体会与包含多种消化酶的溶酶体融合在一起,形成吞噬溶酶体。食物颗粒会被消化,营养物质会被输送到细胞质基质中以供给其它新陈代谢过程使用。
注释
- 一种用于清除凋亡细胞的机制。
- 一类存在于体液中的受体分子,可以自由浮动。
- 一种可以利用来自多种来源的营养物质的微生物。
参考文献
- The Immune System, Peter Parham, Garland Science, 2nd edition
- (PDF). [2012-07-11]. (原始内容 (PDF)存档于2016-03-03).
- Ishimoto H; Yanagihara K; Araki N; et al. . Jpn. J. Infect. Dis. July 2008, 61 (4): 294–7 [2012-07-11]. PMID 18653972. (原始内容存档于2008-09-13).
- Mukundan L, Odegaard JI, Morel CR, Heredia JE, Mwangi JW, Ricardo-Gonzalez RR, Goh YP, Eagle AR, Dunn SE, Awakuni JU, Nguyen KD, Steinman L, Michie SA, Chawla A. (2009)PPAR-delta senses and orchestrates clearance of apoptotic cells to promote tolerance.Nat Med. 2009 Nov;15(11):1266-72.
- Roszer T, Menéndez-Gutiérrez MP, Lefterova MI, Alameda D, Núñez V, Lazar MA, Fischer T, Ricote M. (2011) Autoimmune kidney disease and impaired engulfment of apoptotic cells in mice with macrophage peroxisome proliferator-activated receptor gamma or retinoid X receptor alpha deficiency.J Immunol. 2011 Jan 1;186(1):621-31. PMID 21135166
- Kruse K, Janko C, Urbonaviciute V, Mierke CT, Winkler TH, Voll RE, Schett G, Muñoz LE, Herrmann M. (2010) Inefficient clearance of dying cells in patients with SLE: anti-dsDNA autoantibodies, MFG-E8, HMGB-1 and other players. Apoptosis. 2010 Sep;15(9):1098-113. PMID 20198437
- Han CZ, Ravichandran KS. (2011) Metabolic Connections during Apoptotic Cell Engulfment. Cell. 147(7):1442-5. PMID 22196723
- Boettner DR; Huston CD; Linford AS; et al. . PLoS Pathog. January 2008, 4 (1): e8 [2012-07-11]. PMC 2211552
 . PMID 18208324. doi:10.1371/journal.ppat.0040008. (原始内容存档于2011-07-27).
. PMID 18208324. doi:10.1371/journal.ppat.0040008. (原始内容存档于2011-07-27). - . [2012-07-11]. (原始内容存档于2008-12-20).
- Grønlien HK, Berg T, Løvlie AM. . J. Exp. Biol. July 2002, 205 (Pt 14): 2089–97 [2012-07-11]. PMID 12089212. (原始内容存档于2020-05-29).