硫的同素异形体
硫有著大量的同素異形體,其數量只是僅次於碳。[1]除了有很多同素异形体,每个同素异形体通常还有各种同质异形体(相同结构的硫分子的不同晶体结构),由希腊字母前缀(α、β 等)区分。[2]

此外,由于硫元素几个世纪以来一直都是一件商品,它的各种同素异形体都被赋予了传统名称。早期的工人发现了一些后来被证明是硫的单一或混合的同素异形体。某些形式以其外观命名,例如 “珍珠硫之母”,或者以在鉴定它们的方面非常杰出的化学家命名,例如 “Muthmann硫I”或“Engel硫”。[2][3]
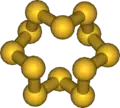
最常见的硫形式是 S
8 的正交晶系同质异形体,为褶皱环结构(见右图)。S8还有另外两种同质异形体,也具有几乎相同的分子结构。[4]除了 S8,以外,含有 6、7、9–15、18 和20个原子的硫环也是已知的。[5] 在五种高压同素异形体中,有两种有金属性。[6]
硫的同素异形体的数量反映了相对较强的S-S键,键能 265 kJ/mol。[7]此外,与大多数元素不同,硫的同素异形体可以在有机溶剂中进行处理,并且可以通过HPLC进行分析。[8]
氣態同素異形體
四硫S4
在硫蒸汽存在。根據理論計算的最新觀點認為四硫有著環狀結構。[9]
固體環狀結構
环-S6.环-S10加合物
這是由含S6和S10的二硫化碳中之溶液製備所得。
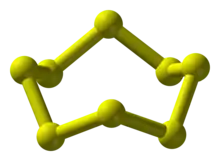
环七硫S7
為亮黄色固体,有α、β、γ、δ四种结构。環七硫的環有著不尋常幅度的鍵長(199.3–218.1 pm),因此被認為是最不穩定的同素異形體。
S8
_V.1.svg.png.webp)
斜方硫(菱形硫)(α-硫)
α-硫是硫自然界中最常見的形式,[1]其純淨時的顏色是黃綠色(市面上出售的硫因為有著微量的环七硫而呈現更黃的顏色)。α-硫實際上不溶於水,導熱性能差,為一良好的電絕緣體。此是硫由二硫化碳結晶而得之緊密的黃色晶體,融點112.8度。
單斜硫(β-硫)
融化硫於部分凝固後,倒出多餘液體,剩下無數之針形晶體即為單斜硫,融點119.2度。
彈性硫
為沸騰之硫注入冷水所得之軟黏體,有彈性。
參考資料
- Greenwood, N. N.; Earnshaw, A. 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- Steudel, 17
- Greenwood, 654
- Greenwood, 655
- Steudel, 59
- Tebbe, F. N.; Wasserman, E.; Peet, W. G.; Vatvars, A.; Hayman, A. C. . Journal of the American Chemical Society. 1982, 104 (18): 4971. doi:10.1021/ja00382a050.
- Ming Wah Wong, Ralf Steudel. . Chemical Physics Letters. 2003, 379 (1-2): 162–169. Bibcode:2003CPL...379..162W. doi:10.1016/j.cplett.2003.08.026.
- R. Steudel (编). . Springer. 2004. ISBN 3540401911.
- Egon Wiberg, Arnold Frederick Holleman. . Elsevier. 2001. ISBN 0-12-352651-5.