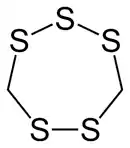
多硫化物
多硫化物的鹽類及錯合物
多硫化物的鹼金屬鹽類可以用硫化物(如硫化鈉)溶液和元素硫反應:
- S2−
+ n S → S2−
n+1
有些,多硫化物離子也可以用可溶於有機溶劑中的有機鹽製備[2]。
多硫化物其溶液一般都为黄色,且颜色随n值的增加而加深。多硫离子类似于过氧化物,具有氧化性,但不及过氧离子氧化性强:
- S22− + 2e− = 2S2−; E
o= -0.476V - HO2− + H2O + 2e− = 3OH−; E
o= 0.87V
- Sn2− + 2H+ → H2S + (n-1)S
鈉和元素硫反應產生的能量是電池科技的基礎,鈉硫電池及鋰硫電池需要高溫才能維持液體多硫及有Na+傳導性,不和鈉、硫及硫化鈉反應的薄膜。
多硫是配位化學中的配基。過渡金屬多硫配合物的例子有(C5H5)2TiS5、[Ni(S4)2]2−,及 [Pt(S5)3]2−[3]。主族金屬元素也可以形成多硫配合物[4]。
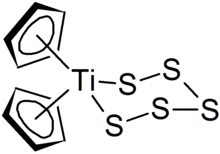
有機多硫化物
在商業上,"polysulfide"常常是指一種用不同的硫離子和碳氫化合物組成的聚合物,其化學式為R2Sx,其中x指硫原子的個數。,多硫聚合物可以用雙鹵素烴類和多硫鹼金屬鹽類反應,透過縮合聚合反應而成:
- n Na2S5 + n ClCH2CH2Cl → [CH2CH2S5]n + 2n NaCl
縮合聚合反應中用的雙鹵素烴類是雙氯烷類,(例如1,2-二氯乙烷]、双(2-氯乙氧基)甲烷(ClCH2CH2OCH2OCH2CH2Cl)及1,3-二氯丙烷。有時多硫聚合物可以用開環聚合反應製備。
多硫聚合物也可以用多硫化物和烯類的加成反應製備,理想的反應式如下:
- 2 RCH=CH2 + H2Sx → (RCH2CH2)2Sx
不過勻相的H2Sx很難製備[1]。
多硫聚合物不溶於水、油及許多的有機溶劑。因為多硫聚合物不會被許多的有機溶劑溶解,多硫聚合物會作為密封劑來填補路面、車輛的車窗玻璃,以及飛機結構。
若聚合物中只含有一個硫,或二個硫之間有其他原子隔開,一般就不視為多硫聚合物,例如聚苯硫醚 (C6H4S)n。
硫化橡膠中的多硫化物
許多商業生產的弹性体聚合物的交叉鏈接中會含有多硫化物。交叉鏈接會使聚合物鏈和鄰近的鏈連結,增強其剛性。剛性的程度和交叉鏈接的數量有關,因此弹性体在變形後可以恢復原來的形狀。也因為弹性体可記憶其原有形狀的特性,一般會用橡膠來指稱弹性体。在聚合物中加入硫,增加交叉鏈接的程序稱為硫化。硫鏈會連接到烯丙基的碳原子,鄰近C=C雙鍵。硫化程序出現在許多橡膠的製程中,例如聚氯丁二烯(氯丁橡胶TM)、丁苯橡胶及聚異戊二烯,這些橡膠在化學上類似天然橡膠。查尔斯·古德伊尔發現將異戊二烯和硫一起加熱的硫化反應,有革命性的影響,將一個黏稠幾乎無用的材料轉換為弹性体,可以再進一步用來製作其他產品
參考資料
- Ralf Steudel "Sulfur: Organic Polysulfanes" Encyclopedia of Inorganic Chemistry 2007, Wiley-VCH, Weinheim. doi:10.1002/0470862106.ia233.pub2.
- Dev, S.; Ramli, E.; Rauchfuss, T. B.; Wilson, S. R. . Inorg. Chem. 1991, 30 (11): 2514. doi:10.1021/ic00011a011.
- Draganjac, M. E.; Rauchfuss, T. B., "Transition Metal Polysulfides: Coordination Compounds with Purely Inorganic Chelate Ligands", Angewandte Chemie International, Edition in English, 1985, vol. 24, 742. doi:10.1002/anie.198507421
- Takeda, N.; Tokitoh, N. and Okazaki, R., "Polysulfido Complexes of Main Group and Transition Metals", Topics in Current Chemistry, 2003, vol. 231, 153-202. ISBN 3-540-40378-7. doi:10.1007/b13184
- . [2015-03-11]. (原始内容存档于2008-06-05).