小脑
小脑(,指「大腦後下方的腦」)是位于后颅窝的脑组织。小脑在感觉感知、协调性,和运动控制中扮演重要角色;它也和注意、语言等很多认知功能相关,亦能调控恐惧和欢乐等反应[1],其中最为人们确知的是其运动相关功能。小脑不會主動发起动作,但會接收來自脊髓感覺系統和其他腦區的訊號,影响运动协调、精确度和准确的时机控制。小脑通过丘脑等通路与大脑皮层相连,从而起到支配运动协调性的作用;下小脑接受来自脊髓小腦徑以及下橄榄核等结构的输入,整合多方面的信息,来微调运动的准确性,协调性和连贯性[2]。正由于小脑的功能是“微调”运动技能,所以小脑的损伤不会带来诸如瘫痪的严重症状,但是会导致精细动作技能、平衡能力、姿势和动作学习方面的症状。[2]18世纪的科学研究表明,小脑受损的病人表现出运动协调性障碍;19世纪的小脑研究则主要基于动物损伤实验。这类实验发现,动物的小脑受损以后,表现出动作异常、步态笨拙,以及肌肉无力。这些观察最终使学者得出结论:小脑的主要功能是运动控制。不过,现代生物医学研究表明,除了运动以外,小脑还有许多其他功能,例如认知功能,注意力和语言处理,音乐处理,在时机控制方面也有重要作用。
| 小脑 | |
|---|---|
 Figure 1a:A 人脑,小脑显示为紫色 | |
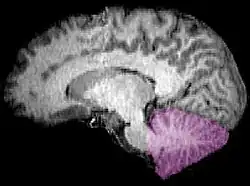 Figure 1b:核磁共振成像显示人脑的中矢面,小脑显示为紫色 | |
| 基本 | |
| 屬於 | 後腦 |
| 动脉 | 小脑上动脉、小脑前下动脉、小脑后下动脉 |
| 静脉 | 小脑上静脉、小脑下静脉 |
| 标识字符 | |
| 拉丁文 | Cerebellum |
| MeSH | D002531 |
| NeuroNames | 643 |
| NeuroLex ID | birnlex_1489 |
| TA98 | A14.1.07.001 |
| TA2 | 5788 |
| FMA | FMA:67944 |
| 格雷氏 | p.788 |
| 《神经解剖学术语》 | |
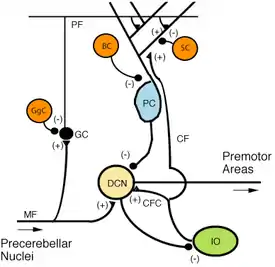
在解剖外观上,小脑是一个位于脑下方的独立结构,藏在大脑半球之下。小脑与中脑、脑桥基底、延髓相连,可以分为前庭小脑、脊髓小脑与大脑小脑。它的皮质表面遍布着构造精细的平行沟槽,和大脑皮质宽阔而不规则的沟回形成鲜明对比。这些平行沟槽的结构,常常会使人忘记小脑其实是一个连续的薄片状组织,它像手风琴那样紧密地折合起来。在这个薄片里,有多种神经元高度有序地组合,其中最重要的是浦金氏细胞和小脑颗粒细胞。复杂的神经组织赋予了小脑巨大的信息处理能力,但是几乎所有的输出,都经过一个位于小脑内部称为小脑深部核团的组织。
小脑除了在动作控制方面的功能,它还是多种动作学习,也就是调制感觉-动作关系所必需的器官。人们建立了许多模型,来解释小脑的突触可塑性是如何校准感觉和动作的关系。它们大多源于大卫·马尔和詹姆斯·阿尔布斯的模型,这个模型的基础,是每个小脑浦肯野细胞都接受两种完全不同的输入:一种是来自平行纤维的数千种输入,另一种是来自爬行纤维的极强的输入。马尔-阿尔布斯模型的基本概念是,爬行纤维提供“指导信号”,导致平行纤维输入强度的长时变化。在平行纤维输入所观察到的长期抑制作用支持了这类理论,但是它们的有效性还有争议。
解剖
在大体解剖学的层面上,小脑包括一个紧密摺叠的皮质,其下是白质,底部是充满液体的第四脑室。在微观结构上,白质中埋藏着四个小脑深部核团。皮质的每一部分都包含了同样的一些神经元组成,形成了高度一致的结构。在介观结构上,小脑和其辅助结构可以被分为上百或者上千个独立的功能模块,称为「微区」(,或)。
大体解剖學
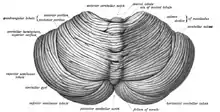
小脑位于后颅窝。前方有第四脑室、桥脑和延髓等構造。[3]它与其上方的大脑以一层革质的硬脑膜相隔开,称为小腦天幕;它与脑的其他部分的所有联系都要通过桥脑。解剖学家们将小脑归为後腦的一部分。後腦是位于菱脑前端的一个区域,桥脑也包含在中脑之内。和大脑皮质一样,小脑也分为两个半球,而蚓部位于两个部分中间。为了方便起见,会通过一些大的皱褶将小脑结构分为10个“小叶”。小脑中含有大量微小的颗粒细胞,所以小脑虽然只占脑体积的10%,但是包含的神经元数量超过脑的其余部分之和。[4]小脑的神经元数量和新皮质中的神经元数量有联系,前者是后者的3.6倍,这个比例在许多不同的哺乳动物身上保持恒定。[5]
小脑在外觀上與其他腦區極為不同,可輕易區分,因其大部分体积由非常紧密摺叠的灰质层——小脑皮质构成。皮层上的凸起被称作小脑叶。据估计,如果人类小脑皮质完全展开,会是一条长达1米,平均宽度5厘米的神经组织。这块表面积大约500平方厘米的区域,被塞进一个6 cm×5 cm×10 cm的体积内。[4]在灰质之下是白质,由大量髓鞘化的神经纤维在皮质之间建立联系,它有时被称作小脑活树,因为它的枝杈形状像一棵树,其中埋藏着4个由灰质组成的小脑深部核团。[6]
分区
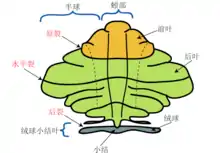
从外观上可以把小脑分为三个叶:小脑前叶(位于小腦初級裂的上方)、小脑后叶(位于小脑初級裂的下方),以及小脑绒球小结叶(小腦後裂下方)。这三个部分将小脑从头端到尾端分开(对于人类来说就是从上到下)。然而从功能上来说,中心-侧面维度上的划分显得更重要。有独特联结和功能的绒球小结叶可以单独考虑,其余的小脑部分可以按照功能划分为中间的脊髓小脑和位于边缘的更大的大脑小脑[6]。在中央的窄带上有一个沿着中线的突触组织,称为小脑蚓部(vermis,拉丁文意为蠕虫)[6]。
绒球小结叶是其中最小的部分,常常被称为前庭小脑。在演化史上,這個區域極早即出現於動物身上,被称作古小脑(archicerebellum),主要参与平衡和空间定位功能。它主要联结到前庭核,但是也接受视觉和其他感觉输入。这一区域的损坏会引起平衡和步态失调[6]。
前叶和后叶的中心部分组成了脊髓小脑,也被称为舊小脑(paleocerebellum),这个部分的主要功能是精细调节身体和肢体。它接收脊髓背柱(包括脊髓小脑束)传导的本體感覺,以及三叉神经的输入,还有视觉和听觉系统的输入。此區的神经纤维會伸入小脑深部核团,投射到大脑皮层和腦幹,对下行运动系统進行精细控制[6]。
小脑外侧的区域,在人类身上是明显最大的区域,组成了大脑小脑(cerebrocerebellum),也称作新小脑(neocerebellum)。它主要通过桥核接受来自大脑皮质(特别是顶叶)的信息,构成皮质-桥脑-小脑通路。他的信息主要輸入丘脑腹外侧,再送至大腦皮質上的前运动区和初級運動皮質。另有一部份則由大脑小脑送入紅核[6]。如何准确地描述小脑侧部的功能,目前还存在争议:人们认为它与即将发生的动作的规划有关[7],也为运动提供对感官信息的评估[6],还和许多纯粹的认知功能有关,例如选择对于一个名词最适合的动词,比如为“椅子”选择“坐”[8][9][10][11]。
微观解剖
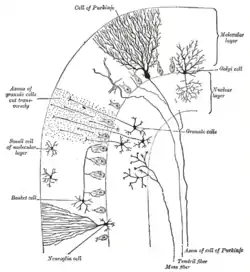
在小脑回路中扮演主要角色的神经元有两种:浦肯野细胞和小脑颗粒细胞,而主要的轴突有三种:苔藓状纤维、爬行纤维(从外部进入小脑)和平行纤维(作为颗粒细胞的轴突)。在小脑回路中有两个主要的通路,发源于苔藓状纤维和爬行纤维,终结于小脑深部核团。[4]
苔藓状纤维直接投射到深部核团,但是也产生了以下通路:苔藓状纤维→颗粒细胞→平行纤维→浦肯野细胞→深部核团。爬行纤维投射到浦肯野细胞,侧枝则直接输出到深部核团。[4]苔藓状纤维和攀爬纤维携带了各自纤维特有的信息;小脑也接受多巴胺、血清素、去甲肾上腺素和乙酰胆碱的输入,可能是用于全局的调节。[12]
小脑皮质分为三层。底层是较厚的颗粒细胞层,密布着颗粒细胞,也有中间神经元,主要是高尔基细胞,也包括卢加洛细胞和单極刷细胞。中层主要是浦肯野细胞,在这片狭窄的区域里包括浦肯野细胞和放射状胶质细胞。顶层是分子层,包括平摊的浦肯野细胞的树突,以及大量的平行纤维,以直角穿过浦肯野细胞的树突。小脑皮层的最外层还包括两类抑制性中间神经元:星状细胞和篮状细胞。星状细胞和篮状细胞都与浦肯野细胞组成了GABA突触。[4]
浦肯野细胞

浦肯野细胞是脑中最特别的神经元之一,也是最早辨认出来的一批神经元。它首先是由捷克解剖学家杨·伊万杰列斯塔·浦肯野于1837年描述,这些细胞因其树突丛的形状得到了辨认:树突丛非常发达,然而高度集中于和小脑沟回垂直的一个平面上。于是,浦肯野细胞的树突组成了一张致密的平面网络,平行纤维以直角穿过它们。[4]它们的树突为树突棘所覆盖,树突棘接受来自平行纤维的突触输入。浦肯野细胞所接受的突触输入多于脑中的任何其他细胞,人类的单个浦肯野细胞的树突棘数量高达200000个。[4]浦肯野细胞巨大、球形的细胞体组成了小脑皮质中薄薄的一层,只有单个细胞的厚度,称为“浦肯野层”。它们的轴突侧枝伸入邻近的皮层区域,轴突则到达小脑深部核团,每一个细胞都在一个相当小的区域内和上千个各种类型的细胞联结。浦肯野细胞使用GABA作为神经递质,所以对于突触后细胞产生抑制作用。[4]
浦肯野细胞形成了小脑回路的核心,它们较大的体积、特殊的活动模式,使其相对易于使用细胞外场电位技术来记录它们的反应模式。浦肯野细胞通常会保持高频率的动作电位发放,即使在没有突触输入的情况下。对于通常清醒的、行动中的动物,典型的平均速率是大约40Hz。动作电位脉冲表现为两种脉冲的混合,分别成为简单脉冲和复杂脉冲。简单脉冲是单个动作电位,紧接着大约10ms的不应期;复杂脉冲是一些固定模式的动作电位序列,其中有非常短的脉冲之间的间隔,脉冲数量逐渐减少。[14]生理学研究表明,复杂脉冲(基频大约为1Hz,最高不会超过10Hz太多)和爬行纤维的活动有可靠的关联;而简单脉冲是由基线活动和平行纤维的输入共同产生的。复杂脉冲之后通常会有一个数百微秒的停顿,在此期间简单脉冲的活动被抑制。[15]
颗粒细胞

小脑颗粒细胞和浦肯野细胞不同,是脑中最小的细胞之一。它们也是脑中数量最多的神经元:人类的颗粒细胞数量据估计大约平均为500亿个,这意味着脑中大约3/4的神经元都是小脑颗粒细胞。[4]它们的细胞体组成了小脑皮层底部的厚厚一层。一个颗粒细胞仅仅长出4-5个树突,它们的末端膨大,称为“树突爪”(dendritic claw)。[4]这些膨大上分布着苔藓状纤维的兴奋性输入和高尔基细胞的抑制性输入。[4]
颗粒细胞纤细而没有髓鞘化的轴突,垂直地伸入小脑皮质的上层(分子层),它们在此分为两支,分别水平反向延伸形成了平行纤维;垂直的纤维与水平的两支纤维形成了独特的“T”形。人类的平行纤维每一侧平均长度为3mm,总长度就是6mm,相当于皮质层宽度的1/10。[4]在平行纤维经过的浦肯野细胞的树突丛中,每3-5个就会有一个形成联结,总共会和浦肯野细胞的树突棘形成大约80-100个突触联结。.[4]颗粒细胞使用谷氨酸作为神经递质,所以对于突触后细胞起着兴奋作用。[4]
颗粒细胞所有的输入都是来自苔藓状纤维,但是在数量上是苔藓状纤维的200倍(人类的情况)。所以,会有很多的颗粒细胞的活动信息来源于同样的苔藓状纤维,但是它们会以很多不同的方式来编码。因为颗粒细胞很小,而且排列紧密,所以在活的动物身上记录它们的活动非常困难,所以可用作建立理论模型的数据很少。最广为人知的功能理论是大卫·马尔于1969年提出的,他认为颗粒细胞可以编码苔藓状纤维输入之间的关系。因为每一个颗粒细胞都会接受4-5根苔藓状纤维的输入;然而如果只有一根纤维有输入活动,那么颗粒细胞不会有反应;如果有一根以上的输入,则可以激活。小脑的这一联合编码框架,使得它有能力对于输入模式进行更精细的区分,比苔藓状纤维自身的能力更强。[16]
苔藓状纤维
苔藓状纤维伸入颗粒细胞层,它们的发源地一些来自桥核,另一些来自脊髓和前庭核等等。在人类小脑中,苔藓状纤维的总数有大约2亿。[4]这些纤维和颗粒细胞和小脑深部核团的细胞形成兴奋型突触。在颗粒细胞层里,苔藓状纤维形成一系列称为“玫瑰结”(rosettes)的膨大结构。苔藓状纤维和颗粒细胞树突的联结形成于称为颗粒小球的结构中。每一个颗粒小球中心都有苔藓状纤维的玫瑰结,多达20个的颗粒细胞树突爪和它连接。高尔基细胞的终端伸入这个结构,在颗粒细胞的树突上形成抑制性突触。这一整个组织由胶质细胞组成的壳包围着。[4]每一个苔藓状纤维伸出侧枝到许多小脑叶,总共会形成20-30个玫瑰结;这样,每个苔藓状纤维会与大约400-600个颗粒细胞形成联结。[4]
爬行纤维
浦肯野细胞也接受来自位于脑干两侧的下橄榄核通过爬行纤维(Climbing fiber也成为攀援纤维)的输入。虽然下橄榄核位于延髓,接受来自脊髓、脑干和大脑皮质的输入,但是它的输出全部指向小脑。爬行纤维在到达小脑皮质之前,从两侧伸向小脑深部核团,在此分出大约10条终端枝杈,每一条联结到一个浦肯野细胞。[4]每一个浦肯野细胞只接受一条爬行纤维的输入,和来自平行纤维的上10万个输入形成鲜明对比。但是这单独的一根爬行纤维“攀援”着浦肯野细胞的树突,缠绕并形成多达300个突触。[4]这个网络提供非常强的输入,只要一个来自爬行纤维的动作电位输入,就会造成浦肯野细胞的一个持续的复杂脉冲:包含许多数量逐渐衰减的脉冲的序列,其后有一段活动抑制的暂停时间。爬行纤维的轴突覆盖了细胞体和临近的轴突;在这个区域里,缺少平行纤维的输入。[4]
爬行纤维以低速率激活,但是爬行纤维的单个动作电位就可以引起目标浦肯野细胞的许多激活。浦肯野细胞接受的平行纤维和爬行纤维的输入数量上,相差近10万倍,可能是小脑解剖学中最惊人的事实。这也成为建立理论的重要驱动力。事实上,爬行纤维的功能是小脑研究领域最具争议的课题,主要思路分为两个派别,其一追随马尔和阿尔布斯,坚持爬行纤维的输入主要是作为教导信号;另一派认为它的功能是直接塑造小脑的输出。这两种观点在许多出版物上都各有大量的支持。正如有人评论所说:“当你试图将爬行纤维的功能假说综合起来的时候,感觉就像是在看埃舍尔的画。每一种观点看起来都符合某一些发现,但是如果你试图将不同的观点放在一起,却无法形成关于爬行纤维功能的协调图像。对于大多数研究者,爬行纤维作为动作的校准信号,不管是发放频率调节的正常方式或者作为“出乎预料”事件的信号。对于其他研究者,在爬行纤维群中包含了神经元组同步和节律的信号。”[15]
深部核团
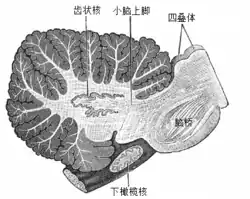
小脑深部核团是一组深藏在小脑核心部位的白质内部的灰质。除了邻近的前庭核以外,它们几乎是小脑皮质唯一的输出管道。这些核团接受来自苔藓状纤维和爬行纤维的两侧投射,以及小脑皮质中的浦肯野细胞的抑制性输入。它分为四个核团,分别为齿状核、球状核、栓状核和顶核,其中球状核与栓状核有时会被合称为中间核。它们都与脑和小脑皮质中的不同部分联结。顶核与中间核属于脊髓小脑的一部分。哺乳动物的齿状核要远大于其他动物的,是一片卷曲的灰质薄片,主要与小脑皮质的两侧形成联结。小脑中的绒球小结叶是小脑皮质中唯一不投射到深部核团的部分,它输出到前庭核。[4]
深部核团中的大部分神经元具有较大的细胞体,球状的树突丛半径大约为400μm,使用谷氨酸作为神经递质。这些细胞投射到小脑以外的许多区域。在它们中间也有少数较小的细胞,使用GABA作为神经递质,只投射到下橄榄核,爬行纤维的发源处。因此,深部核团-橄榄核的投射提供了一个抑制性的反馈,和爬行纤维到深部核团的兴奋性投射相对应。有证据表明,深部核团中的每一组小的细胞团块,都会投射到下橄榄核中将爬行纤维投射到其上得那一团神经细胞;这个双向投射呈现强烈的拓扑吻合。[4]
当浦肯野细胞的轴突进入一个深部核团,它的分叉会和其中的大小细胞都建立联结。在猫的小脑中,其总数目大约只有35个;相比之下,单个深部核团细胞会接受大约860个浦肯野细胞的输入。[4]
皮质功能分区
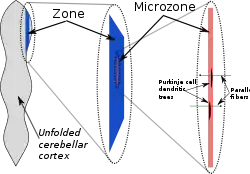
从大体检剖学的角度来说,小脑皮质看起来是一片匀质的组织;对于微观解剖学来说,这片组织的所有部分都有几乎相同的内部结构。然而,小脑也可以按照结构划分为一些部分。其中较大的划分为区域(zones),它们由许多更小的区域组成,称为微区(microzones)。[17]
关于小脑皮质结构划分的最初认识,来自于关于其中细胞感受野的研究。[17]身体的每一部分在小脑中都投射到特定的点,然而这个映射图中有许多重叠区域,组成了称为“有缝躯干地图(体感皮质定位图)”。[18]分区的明确迹象是在对小脑的特定蛋白质进行免疫染色的过程中发现的,其中最有名的称为“斑马”(zebrins),因为它们的染色图案呈现出类似斑马的花纹。“斑马”的条纹和其他区域标记都和小脑沟回垂直,这意味着它们在中侧方向狭窄,但是在纵向较长。不同的标记方式会呈现出不同的条纹,代表功能定位区域的长度和宽度都有变化,但是它们的大致形状都是一致的。[17]
在1970年代后期,奥斯卡松(Oscarsson)提出,这些皮质区域可以被分为更小的单位,称作微区(microzones)。[19]微区定义为一组具有同样的体感皮质定位感受野的浦肯野细胞。一个微区大约包含1000个浦肯野细胞,形成长条形的窄带,和皮质沟回垂直。[17]如右图所示,浦肯野细胞的树突延伸方向与微区一致,而平行纤维以直角穿过它们。[4]
定义微区结构的并不仅仅是感受野:来自下橄榄核的爬行纤维输入同样重要。爬行纤维的分支(通常大约为10条)通常会刺激属于同一个微区的浦肯野细胞。不仅如此,输入同一微区的爬行纤维所起源的下橄榄核细胞通常会以间隙连接相连,导致其活动同步,从而该微区内的浦肯野细胞也会以毫秒尺度同步发放复杂脉冲。[17]另外,属于同一个微区的浦肯野细胞还会将轴突伸向小脑深部核团中的同一组神经元。[17]最后,篮状细胞的轴突在纵向会比中侧向长很多,使得它们很大程度上属于单个的微区。[17]这些结构说明,同一微区之间神经元的联系,比不同微区之间的要强得多。[17]
2005年,理查德·阿普斯(Richard Apps)和马丁·伽尔维茨(Martin Garwicz)发现多个微区可以组成一种更大的单位,称为“多区微组合”(multizonal microcomplex)。这种微组合包含许多空间上分散的皮质微区,它们都投射到同一组深部核团细胞,投射到该组深部核团细胞的同一组下橄榄核细胞,也会投射到它们。[17]
功能
探索小脑功能最有力的线索,就是检查其损伤带来的后果。动物和人类的小脑功能损坏所带来的后果是,损坏的小脑同一侧的身体的动作控制出现问题。他们仍然可以做动作,但是失去了精确度,动作不稳定、笨拙,或者把握不准恰当的时机。测量小脑功能的标准测试是,用指尖伸向一手臂远的目标:健康人会以笔直的轨迹移动指尖,但是小脑损伤的患者的伸手指动作缓慢且不稳定,中途会有许多次修正。检测运动之外的其他功能丧失更困难。所以,直到最近十几年人们才得出结论,小脑的基本功能是计算运动的准确形式,而不是发起运动或者决定以哪种方式运动。簡單來講,就是協調全身肌肉活動、維持身體平衡。[6]
在1990年以前,人们普遍相信小脑的功能纯粹只是运动相关的,但是新的发现使得人们对这个观点产生了疑问。功能性影像研究展示,小脑的功能与语言、注意和精神影像有关;相关的研究显示了小脑和大脑皮质的非运动区域存在关联;人类的许多非运动的症状被确认为和小脑的损伤有关。[20][21]特别是成人[22]与儿童[23]的小脑性认知与情感综合征(CCAS)得到了描述。基于对小脑的功能性磁共振成像扫描所作的估计,表明多于一半的小脑皮质区域和大脑皮质的对应区域有联系。[24]
铜谷贤治(Kenji Doya)提出,与其使用小脑所参与的行为来定义它的功能,不如转而使用小脑所进行的神经计算方式来定义;小脑包含大量相对独立的模块,都具有同样的内部几何结构规则;所以,可以认为它们在进行同样的计算。如果一个模块的输入和输出联结到运动区域(许多模块如此),那么这些模块就和运动行为相关;如果它与其他非运动认知区域联结,那么这个模块就和其他的行为相关。所以,小脑和许多不同的功能特性的调整相关,例如感情、情绪与行为。[25][26]铜谷提出,小脑的功能可以被理解为基于“内在模型”的动作预测;或者是一个监督式学习的装置。它和基底核不同,后者相当于进行强化学习,而大脑皮质进行的是非监督式学习。[21][27]
定律
小脑的解剖结构相对简单而规律,使得人们很早就期望它的功能也是如此简单,在最早的一批小脑电生理学的著作中就表达出这样的愿望:在约翰·卡鲁·埃克尔斯、伊藤正男和János Szentágothai所著的《小脑作为神经机器》(The Cerebellum as a Neuronal Machine)中就是如此。[28]虽然对于小脑的完全理解还尚未达成,但至少已经发现了四条重要的定律(1)前馈过程;(2)分散与汇聚;(3)模块化;(4)可塑性;
- 前馈过程:小脑和其他脑区的最主要不同(特别是和大脑皮质的不同),是它的信号处理方式几乎都是前馈的。这意味着信号单向地从输入到输出,内部的复杂环路非常少。少数的环路也是互相抑制的,小脑中没有互相兴奋的环路。小脑的前馈模型意味着,它和大脑皮质相比缺乏产生自我维持的神经活动模式的能力。进入回路的信号会按照既定的顺序一步步处理,然后离开。就如埃克尔斯、伊藤和Szentágothai所写道:“在小脑的设计中排除了所有的兴奋性神经环路,对于它以计算机的方式运行无疑是巨大的好处,因为神经系统其它部分对于小脑的要求,大概不是复杂回路运行导致的输出,而是对于特定信息快速而清晰的回应。”[29]
- 分散与汇聚:在人类的小脑中,来自大约2亿根苔藓状纤维的输入信息分散到约400亿的小脑颗粒细胞,它们的平行纤维涵盖了1500万浦肯野细胞。[4]基于它们纵向的排列方式,同属一个微区的大约1000个浦肯野细胞会接受来自大约1亿根平行纤维的输入,然后它们自己的输出会集中到不超过50个小脑深部核团细胞中。[17]所以,小脑网络接受不多的输入,然后通过自身严格构建的网络进行大量的处理,最后输出到数量非常有限的细胞。
- 模块化:小脑系统按照功能分成某种程度上相互独立的模块,这样的模块有数百个或者上千个。所有的模块内部结构都类似,但是输入和输出不同。一个模块(按照阿普斯和伽尔维茨的称呼,称为多区微组合(multizonal microcompartment))包含了下橄榄核中的一小团细胞,小脑皮质中的一个窄条里的浦肯野细胞(微区),以及一个小脑深部核团里的一小组神经元。不同的模块会分享来自苔藓状纤维和平行纤维的输入,但是在其他方面它们的功能是独立的——一个模块的输出并不显著影响其他模块的活动。[17]
- 可塑性:平行纤维和浦肯野细胞之间的突触,以及苔藓状纤维和小脑深部核团之间的突触,都是可以改变强度的。在单个小脑模块里,来自多达上10亿的平行纤维的输入转换进入少于50个深部核团细胞,而每个平行纤维对于核团细胞的输出都是可调节的。这样的结构组合,使得小脑对于输入和输出信号之间的精细调整拥有巨大的可塑空间。[30]
学习
有许多证据表明,小脑在某些类型的动作学习中扮演着重要角色。小脑参与的任务中,最明确的是那些需要精细调节的动作执行。学习过程究竟是发生在小脑自身内部,或者它只是给予信号以促进脑的其他结构进行学习,人们还存在争议。[30]将学习过程归于小脑回路的大部分理论都是大卫·马尔[16]和阿尔布斯(James Albus)的观点的延伸。[31]他们认为,爬行纤维提供指导信号,用于引导平行纤维-浦肯野细胞的突触塑造。[32]马尔假设,爬行纤维的输入会导致同步激活的平行纤维输入得到强化。大部分之后的小脑学习模型都是采用了阿尔布斯的假设,即爬行纤维的激活是一个误差信号,会导致同步激活的平行纤维输入弱化。一些之后的模型,像是“自适应滤波器”模型,[33]使用了最优控制理论来理解小脑功能。
多个实验研究对于爬行纤维的活动是误差信号的理论进行了验证,一些实验支持这个理论,但是另一些结果表示存疑。[15]在1977年吉尔伯特和塔赫(Gilbert and Thach)的先驱实验中,猴的浦肯野细胞在学习取物任务中,在动作减少的周期里表现出复杂脉冲的增加,这个过程已知和爬行纤维的输入活动有关。[34]对于动作学习的许多实验中,观察当猫的设想动作和实际动作之间存在差别时会出现复杂脉冲。在对于前庭-眼球反射(用于在头部运动时稳定视觉影像的反射)的研究中,发现爬行纤维的活动会在视网膜滑移(retinal slip)时发生,虽然并不非常直接。[15]
在古典制約中,眨眼条件反射是最为详尽地得到研究的小脑学习过程之一,其中中性的条件刺激(CS),比如声音或者光;重复地和非条件刺激(US),类似会导致眨眼反射的吹气一起出现。当CS和US重复地同时出现,就会在US出现之前单独由CS引起条件反应(CR)。实验表明,在中间核(小脑深部核团中的一个)的一个特定部分,或者小脑皮质中的一个特定部分被损坏之后,眨眼条件反射的学习功能便消失了。如果小脑的输出被药物抑制了,但是它的输入和小脑内部回路仍然保持运作的话,学习过程还可继续,即使动物没有做出任何回应;但是如果小脑内部的回路中断了,则无法学习。这些结果明确表示学习过程发生在小脑内部。[35]
理论与计算模型
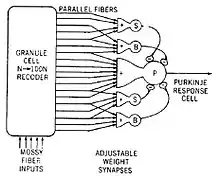
人们关于小脑的丰富基础知识,从解剖结构到行为功能,使得小脑成为了理论模型的沃土。关于小脑的理论模型可能比脑其他任何部分的都要多。这些理论可以最粗略地分为“学习理论”和“执行理论”两种,也就是说,根据小脑的突触可塑性来将其描述为学习的角色,还是将小脑作为运动中信号处理的一部分。这两类理论中有很多都完成了数学模型化并且进行了计算机模拟。[32]
瓦伦蒂诺·布瑞滕堡的“延迟线”理论可能是最早的“执行”理论。这个理论的最早版本由布瑞滕堡和罗杰·阿特伍德(Roger Atwood)于1958年提出,他们认为信号在平行纤维中复制的延后版本可以使得小脑在一定时间窗口内检测信号的时间关系。[36]实验数据并不支持这个理论的最初版本,但是布瑞滕堡继续改进他的模型。[37]小脑作为时间系统的功能假说也得到了理查德·伊夫里(Richard Ivry)的支持。[38]另一个著名的执行理论是张量网络理论,由佩里奥尼茨(Pellionisz)和鲁道夫·里纳斯提出,对小脑的基本计算功能,将感觉转换为运动调整作了进一步的数学描述。[39]
而“学习”类型的理论则几乎都是马尔和阿尔布斯的论文的衍生。马尔1969年的论文提出,小脑是一个将爬行纤维所编码的基本动作和苔藓状纤维编码的环境感觉信息输入联系起来的装置。[16]阿尔布斯于1971年提出,小脑的浦肯野细胞的功能类似于感知器,一种根据神经元结构设计的学习装置。[31]马尔和阿尔布斯理论的最基本区别是,马尔假设爬行纤维的激活会导致平行纤维突触的加强,而阿尔布斯则认为它会减弱。阿尔布斯将他的理论编写为称为CMAC(小脑模型表达控制器,Cerebellar Model Articulation Controller)的软件,在许多应用上经过了测试。[40]
临床表现
小脑功能障碍的最明显症状是和运动相关的。小脑不同区域不同程度的损伤会产生不同的症状。小脑的绒球小结叶(前庭系统部分)的损坏会带来平衡丧失,特别是步态异常,人会保持张开手脚的姿势,表现出保持平衡的困难。[6]两侧区域或者说“大脑小脑”的损坏,会导致熟练的自发和规划的活动发生困难。这会给运动的力量、方向、速度和次数带来错误。一些表现包括肌肉低张力症(肌肉力量减退)、构音障碍(语言发音出现问题)、辨距不良(估计距离或者动作幅度的问题)、轮替动作障碍(无法做出迅速变化的动作)、反射检查损伤或者“回缩现象”,以及意向性震颤(因为拮抗肌肉的不协调而产生的非自主的运动)。[41]中线部分的损伤可能影响身体整体的运动,而越是靠近侧面的损坏就越是可能影响手或者肢体。小脑上部的损伤更可能会影响步态以及其他腿部的协调问题,而下部的损伤更可能导致手臂与手的失调或者运动时难以对准目标,以及速度失调。[6]这些运动综合征统称为失调(ataxia)。
神经系统检查被用来判断小脑的损伤,它包括对步态的评估(宽基步态(broad-based gait)会被诊断为失调),伸手指测试和姿势评估。[2]如果确认了小脑功能缺失,就可以用核磁共振成像来获得图像,找出任何可能的功能异常。[42]
可能导致小脑损伤的医学问题有一个很长的名单:包括脑卒中、出血、脑水肿、赘生物、酗酒、物理创伤(比如枪伤)、以及慢性变性病症,像是橄榄核桥脑小脑萎缩症。[43]某些类型的偏头痛也会导致小脑的暂时失去功能,强烈程度不一。[44]类似传染性海绵状脑病的感染也会引起小脑的损伤,[45]还有米勒费雪症候群,格林-巴利综合征的一个变体。
衰老
人类的小脑会随年龄变化。这些变化和脑的其他部分不同。
在百岁老人的脑中(以及整个身体中),小脑是最年轻的部分,这是通过被称为衰老生物钟,一种表观遗传的测量组织年龄的生物工具得出的结论:百岁老人的小脑比预期的要年轻15岁左右。[46]更进一步地,小脑的基因表达模式比起大脑皮质来更少出现年龄相关的异常。[47]一些研究报告了小脑细胞数量或者组织体积的减少,但是这个数字对于该问题来说并不大。[48][49]
发育和变性失调
先天畸形、遗传失调和后天环境都可以影响小脑的结构,从而影响小脑的功能。除非致病环境可以回复,唯一可能的治疗方案就是帮助人们适应他们的问题。[50]
小脑蚓部的先天畸形或者发育不全会导致丹迪-沃克综合征与茹贝尔综合征。[51][52]在非常罕见的情况下,整个小脑都可能缺失。[53]遗传性的马查多-约瑟夫病、共济失调微血管扩张症候群以及弗里德赖希氏共济失调会导致逐步的与小脑损伤相关的神经变性。[43][50]小脑之外的先天脑畸形也会引起小脑扁桃体疝,在一些类型的阿诺德-基亚里畸形会出现。[54]
其他和小脑变性有密切关系的情况包括自发的慢性神经系统失调多系统萎缩症和一型膝状神经节综合征,[55][56]以及自免疫失调附肿瘤性小脑变性,由于身体其他地方的肿瘤启动了自免疫反应导致小脑神经元受损。[57] 维生素B1的极度缺乏可以导致小脑萎缩,可见于脚气病和科尔萨科夫氏症候群,[58],维生素E的缺乏也会有同样的后果。[50]
小脑萎缩也见于其他神经系统病症,包括亨丁顿舞蹈症、多发性硬化症、[45] 原发性震颤、进行性肌阵挛性癫痫以及尼曼匹克症。暴露在有毒物质中也会导致小脑萎缩,例如重金属,医药性或者娱乐性药物。[50]
比较解剖学与演化

不同纲的脊椎动物的小脑回路都很类似,包括鱼、爬行动物、鸟和哺乳动物。[59]在脑部发达的头足纲动物中也有类似的脑结构,例如章鱼。[60]据此,人们认为小脑对于所有动物物种来说都扮演着重要的功能。
不同的脊椎动物物种之间,小脑的形状和大小相差非常大。对于两栖动物来说,小脑发育很少;对于七鳃鳗和盲鳗来说,很难从脑干中辨识出小脑。虽然在这几类物种中脊髓小脑已经出现,但是最主要的结构还是一对小的核团,相当于前庭小脑。[61]爬行动物的小脑稍大一些,鸟类的要大得多,而哺乳动物的更大。人类和典型的哺乳动物拥有大型、成对和有沟回的小脑叶,而其他动物的小脑仅仅有一个中等大小的小脑叶,而且要平滑得多,或者仅仅稍有沟槽。哺乳动物的新小脑是小脑中重量最大的部分,但是其他的脊椎动物中最大的是脊髓小脑。[61]
软骨鱼和硬骨鱼的小脑异常大而复杂。在至少一个重要方面,它和哺乳动物的小脑内部结构不同:鱼的小脑并不包含分离的小脑深部核团。作为替代,浦肯野细胞的初级投射会指向小脑皮质中分散分布的一类特定细胞,而这种细胞不见于哺乳动物。象鼻鱼科(一种拥有弱电场感应能力的淡水鱼)的小脑非常大,超过脑的其余部分的总和。它的特殊结构中最大的部分称为“瓣膜”(valvula),拥有不寻常的内部结构,大部分输入来自于电感觉系统。[62]
哺乳动物小脑的明显特征是两侧叶的增大,它们主要与新皮质发生联系。当猴演化为大猿,侧叶继续增大,伴随着属于新皮质的额叶增大。对于古人科动物和更新世之前的智人,小脑持续增大,但是额叶增大得更快。而在人类演化的最近期,实际上伴随着小脑相对尺寸的增大,而当小脑增大时,新皮质的尺寸缩小。[63]人类的小脑和脑的其他部分相比尺寸增加,而大脑尺寸减小。[64]伴随着运动任务的发展和执行以及视觉空间的技巧和学习都在小脑中发生,小脑的增长被认为和人类的发达认知能力有关。[65]人类和猿的小脑的两侧半球要比猴的大2.7倍。[64]小脑尺寸的变化不能用更多的肌肉数量来解释。小脑的增长要么和脑其他部分相关,要么小脑中的神经活动对于人科的演化非常重要。基于小脑在认知功能中扮演角色,它的尺寸增大可能与认知的扩展有关。[64]
类小脑结构
许多脊椎动物拥有在细胞结构和神经化学上类似于小脑的脑区域。[59]其中唯一在哺乳动物里发现的是背侧耳蜗核(DCN),直接从耳蜗神经接收输入的两个主要的感觉核团之一。DCN有分层的结构,底层包含和小脑中相似的颗粒细胞,伸出平行纤维到达表层,然后水平地穿过它。表层包括一组GABA能的神经元,称为车轮细胞,在解剖学和化学上类似于浦肯野细胞。它们接收平行纤维的输入,但是没有类似于爬行纤维的输入。DCN的输出神经元是锥体细胞。它们是颗粒状的,但是也在某些方面和浦肯野细胞相似:它们拥有多棘的、扁平的上层树突丛,接收来自平行纤维的输入,然而它们也有底部的树突,接受来自听觉神经纤维的输入。听觉神经纤维穿过DCN时与平行纤维呈直角相交。DCN在啮齿动物和其他小动物身上得到最高度的发展,但是在灵长类身上明显减小了。它的功能还没有被很好地理解;最流行的解释将它以各种方式和空间听力联系起来。[66]
大部分种类的鱼和两栖动物拥有体侧线系统来感觉水中的压力波。脑中一个接收侧线器官初级输入的部分,称为中听侧核(medial octavolateral nucleus),拥有类似小脑的结构,包括颗粒细胞和平行纤维。拥有电感觉的鱼类,电感觉器官会输出到背听侧核(dorsal octavolateral nucleus),它的结构也类似于小脑。辐鳍鱼(鱼中最大的一类)的上丘的边缘层(marginal layer)也和小脑类似。[59]
所有这些类似小脑的结构似乎都是与初级感觉有关,而不是和运动有关。它们都具有颗粒细胞,会伸出平行纤维连接到类似于浦肯野细胞,具有突触可塑性,但是都没有类似于小脑的爬行纤维的结构。作为替代,它们直接接收来自周围感觉器官的输入。它们的功能都不甚明了,但是最有影响力的猜测认为,它们将感觉输入转换为处理过的形式,可能回用于调整身体姿势。[59]事实上詹姆斯·M·鲍尔等人就基于对这些结构和对于小脑的研究,提出小脑自身其实根本上是一个感觉结构,而它对于动作控制的贡献,是通过控制感觉信号来控制身体动作的。[67]和鲍尔的观点不一致的是,也有强烈的证据表明哺乳动物的小脑直接影响了动作输出。[68][69]
历史
描述
最早期的解剖学家就能够辨识出小脑,因为它的外观如此特别。亚里士多德和赫洛菲洛斯(由盖伦所引用)将其称为parencephalis,以便和encephalon也就是脑相对应。盖伦关于小脑的描述是现存最早的详细描述。他怀疑小脑是运动神经的发源地。[70]
然而,直到文艺复兴时期这方面都没有明显的进展。维萨里简单地讨论了小脑,而托马斯·威利斯于1664年更详尽地描述了它。在18世纪,人们进行了更多的解剖工作,但是在19世纪之前,人们并没有形成对小脑功能的任何见解。路易吉·罗朗多于1809年发表了重要发现,小脑的损伤会导致动作失调。让·皮埃尔·弗卢龙于19世纪上半叶进行了仔细的实验工作,揭示了动物在小脑损坏之后仍然可以存活,但是会失去协调性(奇怪的动作、笨拙的步态和肌肉虚弱),而动物在损伤后可以几乎完全恢复,除非损伤很彻底。[71]到了20世纪初,小脑首要功能是运动控制的观念已经被广泛接受;在20世纪上半叶,出现了一些和人类小脑疾病相关的临床症状的详细描述。[2]
参见
参考文献
- Wolf U, Rapoport MJ, Schweizer TA. . J. Neuropsychiatry Clin. Neurosci. 2009, 21 (3): 245–53. PMID 19776302. doi:10.1176/jnp.2009.21.3.245.
- Fine EJ, Ionita CC, Lohr L. . Semin. Neurol. 2002, 22 (4): 375–84. PMID 12539058. doi:10.1055/s-2002-36759.
- . 40th. 2008: 297. ISBN 978-0-8089-2371-8.
- Llinas RR, Walton KD, Lang EJ. . Shepherd GM (编). . New York: Oxford University Press. 2004. ISBN 0-19-515955-1.
- Herculano-Houzel S. . Front. Neuroanat. 2010, 4:12. doi:10.3389/fnana.2010.00012.
- Ghez C, Fahn S. . Kandel ER, Schwartz JH (编). . New York: Elsevier. 1985: 502–522.
- Kingsley RE. 2nd. Lippincott Williams and Wilkins. 2000. ISBN 0-683-30460-7.
- Petersen SE, Fox PT, Posner MI, Mintun M, Raichle ME. . Journal of Cognitive Neuroscience. 1989, 1: 153–170. PMID 17786810. doi:10.1080/14734220701496448.
- Timmann D, Daum I. . Cerebellum. 2007, 6 (3): 159–62. PMID 23968463. doi:10.1162/jocn.1989.1.2.153.
- Strick PL, Dum RP, Fiez JA. . Annual Review of Neuroscience. 2009, 32: 413–434. PMID 19555291. doi:10.1146/annurev.neuro.31.060407.125606.
- Buckner RL. . Neuron. 2013, 80 (3): 807–815. PMID 24183029. doi:10.1016/j.neuron.2013.10.044.
- Schweighofer N, Doya K, Kuroda S. . Brain Res. Brain Res. Rev. 2004, 44 (2–3): 103–116. PMID 15003388. doi:10.1016/j.brainresrev.2003.10.004.
- Felizola SJA, Nakamura Y, Ono Y, Kitamura K, Kikuchi K, Onodera Y, Ise K, Takase K, Sugawara A, Hattangady N, Rainey WE, Satoh F, Sasano H. . J. Mol. Endocrinol. 2014, 52 (2): 159–167. PMC 4103644
 . PMID 24403568. doi:10.1530/JME-13-0248.
. PMID 24403568. doi:10.1530/JME-13-0248. - Eccles JC, Llinás R, Sasaki K. . J. Physiol. 1966, 182 (2): 268–96. PMC 1357472
 . PMID 5944665.
. PMID 5944665. - Simpson JI, Wylie DR, De Zeeuw CI. . Behav. Brain Sci. 1996, 19 (3): 384–398. doi:10.1017/S0140525X00081486.
- Marr D. . J. Physiol. 1969, 202 (2): 437–70. PMC 1351491
 . PMID 5784296.
. PMID 5784296. - Apps R, Garwicz M. . Nature Rev. Neurosci. 2005, 6 (4): 297–311. PMID 15803161. doi:10.1038/nrn1646.
- Manni E, Petrosini L. . Nature Rev. Neurosci. 2004, 5 (3): 241–9. PMID 14976523. doi:10.1038/nrn1347.
- Oscarsson O. . Trends Neurosci. 1979, 2: 143–145. doi:10.1016/0166-2236(79)90057-2.
- Rapp B. . Psychology Press. 2001: 481. ISBN 1-84169-044-9.
- Doya K. . Curr. Opin. Neurobiol. 2000, 10 (6): 732–739. PMID 11240282. doi:10.1016/S0959-4388(00)00153-7.
- Schmahmann JD, Sherman JC. . Brain. April 1998, 121 (4): 561–79. PMID 9577385. doi:10.1093/brain/121.4.561.
- Levisohn L, Cronin-Golomb A, Schmahmann JD. . Brain. May 2000, 123 (5): 1041–50. PMID 10775548. doi:10.1093/brain/123.5.1041.
- Buckner RL, Krienen FM, Castellanos A, Diaz JC, Yeo BT. . J. Neurophysiol. 2011, 106 (5): 2322–2345. PMC 3214121
 . PMID 21795627. doi:10.1152/jn.00339.2011.
. PMID 21795627. doi:10.1152/jn.00339.2011. - Hernáez-Goñi P, Tirapu-Ustárroz J, Iglesias-Fernández L, Luna-Lario P. [The role of the cerebellum in the regulation of affection, emotion and behavior]. Revista de Neurologia. November 2010, 51 (10): 597–609 [2015-10-03]. PMID 21069639. (原始内容存档于2016-11-18) (西班牙语).
- Turner BM, Paradiso S, Marvel CL, Pierson R, Boles Ponto LL, Hichwa RD, Robinson RG. . Neuropsychologia. March 2007, 45 (6): 1331–41. PMC 1868674
 . PMID 17123557. doi:10.1016/j.neuropsychologia.2006.09.023.
. PMID 17123557. doi:10.1016/j.neuropsychologia.2006.09.023. - Doya K. . Neural Networks. 1999, 12 (7–8): 961–974. PMID 12662639. doi:10.1016/S0893-6080(99)00046-5.
- Eccles JC, Ito M, Szentágothai J. . Springer-Verlag. 1967.
- The Cerebellum as a Neuronal Machine, p. 311
- Boyden ES, Katoh A, Raymond JL. . Annu. Rev. Neurosci. 2004, 27: 581–609. PMID 15217344. doi:10.1146/annurev.neuro.27.070203.144238.
- Albus JS. . Math. Biosciences. 1971, 10 (1–2): 25–61. doi:10.1016/0025-5564(71)90051-4.
- Houk JC, Buckingham JT, Barto AG. . Behav. Brain Sci. 1996, 19 (3): 368–383. doi:10.1017/S0140525X00081474.
- Fujita M. . Biol. Cybern. 1982, 45 (3): 195–206. PMID 7171642. doi:10.1007/BF00336192.
- Gilbert PF, Thach WT. . Brain Res. 1977, 128 (2): 309–28. PMID 194656. doi:10.1016/0006-8993(77)90997-0.
- Christian KM, Thompson RF. . Learn. Mem. 2003, 10 (6): 427–55. PMID 14657256. doi:10.1101/lm.59603.
- Braitenberg V, Atwood RP. . J. Comp. Neurol. 1958, 109 (1): 1–33. PMID 13563670. doi:10.1002/cne.901090102.
- Braitenberg V, Heck D, Sultan F. . Behav. Brain Sciences. 1997, 20 (2): 229–277. PMID 10096998.
- Ivry RB, Spencer RM, Zelaznik HN, Diedrichsen J. . Ann. N. Y. Acad. Sci. 2002, 978: 302–307. Bibcode:2002NYASA.978..302I. PMID 12582062. doi:10.1111/j.1749-6632.2002.tb07576.x.
- Pellionisz A, Llinás R. . Neuroscience. 1982, 7 (12): 2949–70. PMID 7162624. doi:10.1016/0306-4522(82)90224-X.
- Horváth G. (PDF). Intelligent Control Systems and Signal Processing. 2003 [2009-12-24]. (原始内容存档 (PDF)于2020-05-20).
- Schmitz TJ. . O'Sullivan SB, Schmitz TJ (编). . Philadelphia: F. A. Davis. 2007: 193–225.
- Gilman S. . N. Engl. J. Med. 1998, 338 (13): 889–96. PMID 9516225. doi:10.1056/NEJM199803263381307.
- . National Institutes of Health. 16 April 2014 [2 February 2015]. (原始内容存档于2006-09-01).
- Vincent M, Hadjikhani N. . Headache. 2007, 47 (6): 820–33. PMC 3761082
 . PMID 17578530. doi:10.1111/j.1526-4610.2006.00715.x.
. PMID 17578530. doi:10.1111/j.1526-4610.2006.00715.x. - . National Institutes of Health. 28 February 2014 [2 February 2015]. (原始内容存档于2015年2月18日).
- Horvath S, Mah V, Lu AT, Woo JS, Choi OW, Jasinska AJ, Riancho JA, Tung S, Coles NS, Braun J, Vinters HV, Coles LS. (PDF). Age (Albany US). 2015, 7 (5) [2015-10-05]. PMID 25968125. (原始内容存档 (PDF)于2016-03-18).
- Fraser HB, Khaitovich P, Plotkin JB, Pääbo S, Eisen MB. . PLoS Biology. 2005, 3 (9): e274. PMC 1181540
 . PMID 16048372. doi:10.1371/journal.pbio.0030274.
. PMID 16048372. doi:10.1371/journal.pbio.0030274. - Andersen BB, Gunderson HJG, Pakkenberg B. . J. Comp. Neurol. 2003, 466 (3): 356–365. PMID 14556293. doi:10.1002/cne.10884.
- Raz N, Gunning-Dixon F, Head D, Williamson A, Acker JD. (PDF). Am. J. Neuroradiol. 2001, 22 (6): 1161–1167 [2015-10-05]. PMID 11415913. (原始内容存档 (PDF)于2008-12-17).
- Albert, Richard K.; Porter, Robert S. (编). 18th. Whitehouse Station, New Jersey: Merck Research Libraries. 2006: 1886–1887.
- . National Institutes of Health. 23 December 2013 [9 January 2015]. (原始内容存档于2015年1月4日).
- . National Institutes of Health. 14 February 2014 [9 January 2015]. (原始内容存档于2015年1月4日).
- . National Institutes of Health. 29 September 2011 [9 January 2015]. (原始内容存档于2015年1月4日).
- . National Institutes of Health. 10 December 2014 [9 January 2015]. (原始内容存档于2016-12-12).
- . National Institutes of Health. 14 February 2011 [1 February 2015]. (原始内容存档于2015年2月16日).
- . National Institutes of Health. 16 April 2014 [9 January 2015]. (原始内容存档于2012年1月27日).
- . National Institutes of Health. 12 March 2009 [9 January 2015]. (原始内容存档于2015年1月4日).
- . National Institutes of Health. 14 February 2007 [9 January 2015]. (原始内容存档于2015年1月4日).
- Bell CC, Han V, Sawtell NB. . Annu. Rev. Neurosci. 2008, 31: 1–24. PMID 18275284. doi:10.1146/annurev.neuro.30.051606.094225.
- Woodhams PL. . J. Comp. Neurol. 1977, 174 (2): 329–45. PMID 864041. doi:10.1002/cne.901740209.
- Romer AS, Parsons TS. . Philadelphia: Holt-Saunders International. 1977: 531. ISBN 0-03-910284-X.
- Shi Z, Zhang Y, Meek J, Qiao J, Han VZ. . J. Comp. Neurol. 2008, 509 (5): 449–73. PMID 18537139. doi:10.1002/cne.21735.
- Weaver AH. . Proc. Natl. Acad. Sci. U.S.A. 2005, 102 (10): 3576–3580. Bibcode:2005PNAS..102.3576W. PMC 553338
 . PMID 15731345. doi:10.1073/pnas.0500692102.
. PMID 15731345. doi:10.1073/pnas.0500692102. - Schoenemann PT. . Language Learning. December 1, 2009, 59: 162–186.
- MacLeod CE, Zilles K, SchleicherA, Rilling JK, Gibson KR. . J. Hum. Evol. 2003, 44 (4): 401–429. PMID 12727461. doi:10.1016/S0047-2484(03)00028-9.
- Roberts PD, Portfors CV. . Biol. Cybern. 2008, 98 (6): 491–507. PMID 18491162. doi:10.1007/s00422-008-0217-1.
- Bower JM. . Prog. Brain Res. 1997, 114: 463–96. ISBN 978-0-444-82313-7. PMID 9193161. doi:10.1016/S0079-6123(08)63381-6.
- Heiney SA, Kim J, Augustine GJ, Medina JF. . J. Neurosci. February 2014, 34 (6): 2321–30. PMC 3913874
 . PMID 24501371. doi:10.1523/JNEUROSCI.4547-13.2014.
. PMID 24501371. doi:10.1523/JNEUROSCI.4547-13.2014. - Witter L, Canto CB, Hoogland TM, de Gruijl JR, De Zeeuw CI. . Front. Neural Circuits. 2013, 7: 133. PMC 3748751
 . PMID 23970855. doi:10.3389/fncir.2013.00133.
. PMID 23970855. doi:10.3389/fncir.2013.00133. - Clarke E, O'Malley CD. . 2nd. Norman Publishing. 1996: 629. ISBN 0-930405-25-0.
- Ito M. . Ann. N. Y. Acad. Sci. 2002, 978: 273–288. Bibcode:2002NYASA.978..273I. PMID 12582060. doi:10.1111/j.1749-6632.2002.tb07574.x.
- Lewis CT, Short C. . Oxford: Clarendon Press. 1879.
- Marshall LH, Magoun HW. . Totowa: Humana Press. 1998.
- 余园园. . 浙江财经学院. 2013.
- 合信. . 广州. 1851: 19.
外部連結
| 维基共享资源上的相关多媒体资源:小脑 |
- head and neck(頭頸部)-小腦髓質(cerebellar medulla) (页面存档备份,存于)
- Cerebellum–Cell Centered Database (页面存档备份,存于)
- Stained brain slice images which include the "cerebellum" at the BrainMaps project