微皱褶细胞
微皱褶细胞(Microfold cells)是一种免疫细胞。分布于胃肠道、口腔部(例如扁桃体)、小型唾液腺管、呼吸道、眼角膜、生殖泌尿道等部位。
| 微皱褶细胞 | |
|---|---|
| 基本 | |
| 系統 | 免疫系统 |
| 位置 | gut-associated lymphoid tissue (GALT) of the Peyer's patches in the small intestine, and in the mucosa-associated lymphoid tissue (MALT) of other parts of the gastrointestinal tract |
| 功能 | Antigen uptake |
| 标识字符 | |
| 拉丁文 | epitheliocytus microplicatus |
| MeSH | D000092303 |
| TH | H3.04.03.0.00010 |
| FMA | FMA:62929 |
| 《显微解剖学术语》 | |
简介
在小肠和大肠中,微皱褶细胞散布在淋巴圆顶滤泡区的上皮细胞之间,特别是聚集状态的滤泡相关上皮(Follicle-associated epithelium,FAE)[註 1]。另外,结肠远端和直肠粘膜也分布着丰富的微皱褶细胞。[1]
顶膜的粘膜免疫反应会激活微皱褶细胞,使微生物和粒子(抗原)通过上皮细胞进入肠道内腔,使肠道内腔固有的免疫细胞得以与抗原相互作用。[2]
与邻近的细胞不同,微皱褶细胞有独特的功能。它会在小肠腔内捕捉抗原,抗原會被转运到抗原提呈细胞、树突状细胞和淋巴细胞(T细胞)等。与其他抗原提呈细胞相似,微褶皱细胞也会搬运组织蛋白酵素E,这一过程发生在其基底外侧独特的口袋状结构中。抗原可通过识别细胞表面受体以针对特定细胞,例如以糖蛋白-2(GP2)标识细菌完成抗原锁定。细胞的朊蛋白(PrP)是微皱褶细胞的细胞表面受体标识的另一个例子。[3]
微皱褶细胞缺乏微绒毛,但相似于其他上皮细胞,由强壮的细胞来连接是他们的特点。这构成了一个物理屏障,在免疫系统和肠道内容物中构成防御线。尽管某些抗原是能够渗入微皱褶细胞组成的上皮屏障并感染附近的上皮细胞或进入肠道。[4]
形态与功能
微皱褶细胞和其他肠道上皮细胞形态上有差异。[1]它们的特点细胞表面突起上的微絨毛很短或缺乏。这些微绒毛很短,不规则,分布在顶端表面或口袋状内陷基底外侧表面上。当他们缺乏微绒毛时,它们的特点是它们的微皱褶,也是微皱褶细胞名字的来源。微皱褶细胞远远不及肠道细胞丰富。这些细胞也可以感受到细胞的边缘或细胞表面,如肌动蛋白、绒毛、细胞角蛋白、波形蛋白组成的细胞骨架和细胞外基质。[4]
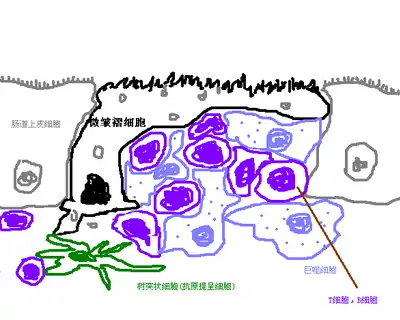 微皱褶细胞的口袋状结构中有大量T细胞和未分化的B细胞,还有少量的巨噬细胞。
微皱褶细胞的口袋状结构中有大量T细胞和未分化的B细胞,还有少量的巨噬细胞。
微皱褶细胞因为不分泌粘液和消化酶,所以拥有较薄的糖萼,也更容易地到小肠腔内。微皱褶细胞的主要功能是选择性运输抗原, 并将其转运到小肠上皮内的巨噬细胞和淋巴细胞, 然后再迁移到淋巴结, 使免疫反应可以开始。[5]
病理学
因为微皱褶细胞与致病因子有着较强的结合能力,所以也常被致病因子利用作一种有效的渗透途径。例如几种革兰氏阴性菌,包括弗氏志贺氏菌、鼠伤寒沙门氏菌和假结核耶尔森氏菌等;其中肠致病性大肠杆菌(EPEC)的质粒含有与大肠杆菌粘附因子(Escherichia coli Adherence Factor)相关的基因,能黏附在微皱褶细胞上。微皱褶细胞也会被病毒所利用,例如能引起脊髓灰質炎的脊髓灰质炎病毒和呼吸孤病毒[6] 。依赖CXCR4受体蛋白的HIV病毒被注意到可以和微皱褶细胞上的CXCR4受体结合,并由此穿过上皮细胞,依赖CCR5受体蛋白感染细胞的HIV病毒则不行。 [7]最后很不幸的是,微皱褶细胞也会为朊毒體 的传染提供便利。[6]
发育
促进微皱褶细胞分化的因素尚不清楚,其分化可能是如派亞氏淋巴叢中存在的免疫细胞所释放的信号促使的。[8] 因为B细胞和微皱褶细胞的发育有关系。滤泡相关上皮(FAE)中含有大量的B细胞,微皱褶细胞也会随着B细胞减少而减少。 另一个例子是, 人类淋巴瘤细胞株会从腺癌细胞转移到微皱褶细胞。 许多研究显示多种细胞可以引导微皱褶细胞分化,最新的研究中还发现了能引发分化的分子。 最近,通过对loss-of-function和rescue-phenotype的研究,RANKL(核因子κ-B配体受体致活剂)被证明为NF-κB配体的受体激活体,其中最关键的是RANKL在小肠中的表达促进了沙门氏菌等抗原的吸收,是微皱褶细胞分化的重要关键因素。[9]有趣的是,在肠道上皮细胞中发现的微生物可以引导微皱褶细胞发育。例如,丙型分泌系统效应蛋白SopB(type III secretion system effector protein SopB)能激活肠上皮细胞转化为微皱褶细胞,[10] 在成为完全成熟的微皱褶细胞前需要经过4天的分化过程。[11]病原体可以利用细胞分化的途径入侵肠上皮细胞。[2]最近的研究表明,它们明显来自于淋巴和髓系血统(myeloid lineages)。[10] 在其中一种情况, 上面提到的SopB效应蛋白被分泌出来,通过上皮细胞间细胞间的间质转换,从而触发在滤泡相关上皮的肠上皮细胞的快速分化。
注释
参考文献
- 陈洁. . 《上海免疫学杂志》. 2001年第21卷第5期317-319页 [2017年8月15日]. (原始内容存档于2022年5月26日).
- Mabbott N.A.; Donaldson D.S.; Ohno H.; Williams I.R.; Mahajan A. . Mucosal Immunol. 2013, 6: 666–677. doi:10.1038/mi.2013.30.
- Miller H.; Zhang J.; Kuolee R.; Patel G.B.; Chen W. . World Journal of stroenterology. 2007, 13: 1477–1486. doi:10.3748/wjg.v13.i10.1477.
- Kanaya, T., and Ohno, H. (2014). The Mechanisms of M-cell Differentiation. 33, 91-97.
- Kenneth M., Murphy (2012). Janeway's Immunobiology. Garland Science.
- Ouzilou Laurent; Caliot Elise; Pelletier Isabelle; Prévost Marie-Christine; Pringault Eric; Colbère-Garapin Florence. . Journal of General Virology. 2002, 83: 2177–2182. doi:10.1099/0022-1317-83-9-2177.
- Fotopoulos Grigorios, Hararidagger Alexandre, MichettiDagger Pierre, Didier , Pantaleodagger Giuseppe, Kraehenbuhl Jean-Pierre. . Proceedings of the National Academy of Sciences: 9410–9414. doi:10.1073/pnas.142586899.
- Kraehenbuhl J, Neutra M. . Annu Rev Cell Dev Biol. 2000, 16: 301–32. PMID 11031239. doi:10.1146/annurev.cellbio.16.1.301. Link (页面存档备份,存于)
- Knoop KA, Kumar N, Butler BR, Sakthivel SK, Taylor RT, Nochi T, Akiba H, Yagita H, Kiyono H, Williams IR. . J Immunol. 2009, 183: 5738–5747. doi:10.4049/jimmunol.0901563.
- Tahoun A, Mahajan S, Paxton E, Malterer G, Donaldson DS, Wang D, Tan A, Gillespie TL, O'Shea M, Roe AJ, Shaw DJ, Gally DL, Lengeling A, Mabbott NA, Haas J, Mahajan A. . Cell Host Microbe. 2012, 12: 645–656. doi:10.1016/j.chom.2012.10.009.
- . Cell Host & Microbe: 607–609. [2016-01-16]. doi:10.1016/j.chom.2012.11.003. (原始内容存档于2022-05-23).
外部链接
- Slide at ucsd.edu (页面存档备份,存于)