抗原原罪
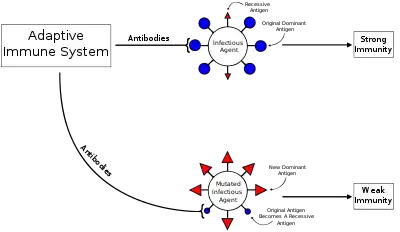
抗原原罪(英語:),又稱霍斯金現象(英語:),[1] 是指身體免疫系統在遭遇到與初次感染有些微不同的外來物(如:病毒或細菌)時,傾向利用初次產生的免疫記憶,而非再次產生免疫反應的一種特性。這會使免疫系統「受制於」初次抗原引起的免疫反應,而不能針對之後的抗原感染產生最有效的反應(前提是兩次接觸的不同抗原僅能有些許差異)。抗原原罪的現象被認為與流感病毒、登革熱、人類免疫缺陷病毒(HIV)和其餘一些病毒有關。[2]
此現象最初由Thomas Francis二世於1960年提出,以《On the Doctrine of Original Antigenic Sin》之名在專欄發表。[3][4]他以神學中原罪的概念作為類比來命名此現象。下文根據最初發現者Thomas Francis,並引述自Richard Krause:[3][4]
"The antibody of childhood is largely a response to dominant antigen of the virus causing the first type A influenza infection of the lifetime. [...] The imprint established by the original virus infection governs the antibody response thereafter. This we have called the Doctrine of the Original Antigenic Sin."
「孩童時期形成的抗體大多都是對付造成一生中首次A型流感感染的病毒的主要抗原。[...]最初病毒感染建立的深刻烙印會掌管隨後的抗體反應。我們稱之為抗原原罪的道理。」(中譯)
在B細胞中
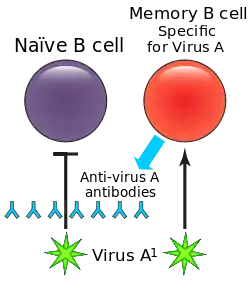
初次感染時,會在體內產生壽命長的記憶B細胞,並為之後的感染提供保護。這些記憶B細胞會與病毒蛋白質表面的特定抗原決定位反應,藉此製造抗原專一的抗體,這樣會比B細胞重新辨認新抗原反應快。這種效果縮短了對抗感染所需時間。
在初次與二次感染間,或疫苗接種後,病毒可能會經歷抗原連續變異,病毒表面的蛋白質(抗原決定位)會透過自然突變調整,病毒得以藉此自免疫系統逃脫。當這件事情發生時,微調過的病毒會傾向重新活化先前活化的高親和力記憶B細胞,並刺激抗體製造。然而,這些B細胞製造的抗體通常都不能有效地與微調過的抗原決定位結合。此外,這些抗體還會抑制更高親和力的初始B細胞活化,而這些初始B細胞本來有可能製造對付二次感染的病毒更有效的抗體。這將導致低效的免疫反應和需要花更多時間清除的反覆感染。[5]
抗原原罪在疫苗應用中尤其重要。[6] 在登革熱中,抗原原罪的效果與疫苗發展有重要牽連。一旦建立起了一種登革病毒反應的血清型,另一種登革熱疫苗就不可能有效了,暗指第一次接種疫苗時就必須均衡地建立所有四種病毒反應的血清型。[7] 然而,在2015年時,一種新型且能有效對付所有四種病毒血清型的高效中和抗體被分離出來,為全球的登革疫苗發展帶來一線曙光。[8]
個體若是反覆免疫化(透過疫苗或是反覆感染),免疫反應對付新病毒株的流感病毒的專一性和品質通常都會降低。[9] 然而,抗原原罪在保護面的影響並未被良好建立,並常會因感染源疫苗、地理位置、和年齡差異而不同。[5] 研究者發現若曾三個月內接種過季節A/Brisbane/59/2007 (H1N1)疫苗,那這群人對2009年H1N1新型流感疫苗反應出的抗體會減少。[6]
在胞毒性T細胞中
相似的現象也在胞毒性T細胞(CTL)中被發現。[10] 在登革熱不同病毒株的二次感染時,胞毒性T細胞傾向釋放細胞激素,而不是造成細胞溶解,這點已被證實。結果是這些釋放的細胞激素被認為會增加血管通透性並惡化內皮細胞的受損。[11]
根據胞毒性T細胞誘發的胞毒反應,許多團隊試圖設計一種針對HIV和C型肝炎的疫苗。胞毒性T細胞可能會因為抗原原罪而偏差,這個發現可能能幫助解釋這些疫苗受限的效能。病毒,像是HIV,具高變異性且常會突變,因此根據抗原原罪,若是感染到表現些微不同的抗原特定位的HIV病毒的話,疫苗可能會控制失敗。事實上,疫苗甚至會使感染更加惡化,因為它會將免疫反應「制約」成最初的、無效的、對付最初病毒的反應。[10]
參考資料
- FDA Center for Biologics Evaluation and Research Vaccines and Related Biological Products: Advisory Committee (页面存档备份,存于)(RTF)
- Deem, Michael W.The Adaptive Immune Response (页面存档备份,存于) Rice University
- Thomas Francis Jr. . Proceedings of the American Philosophical Society. 1960, 104 (6): 572–578. JSTOR 985534.
- Krause R. . Emerg Infect Dis. 2006, 12 (1): 40–43. PMC 3291407
 . PMID 16494715. doi:10.3201/eid1201.051132.
. PMID 16494715. doi:10.3201/eid1201.051132. - Lambert PH, Liu M, Siegrist CA (2005). "Can successful vaccines teach us how to induce efficient protective immune responses?". Nat Med 11(4 Suppl): S54-62,doi:10.1038/nm1216 PMID 15812491
- Choi, Yoon Seok; Baek, Yun Hee; Kang, Wonseok; et al. . Clinical and Vaccine Immunology. September 2011, 18 (9): 1519–1523. PMC 3165229
 . PMID 21813667. doi:10.1128/CVI.05053-11.
. PMID 21813667. doi:10.1128/CVI.05053-11. - Midgley, Claire M.; Bajwa-Joseph, Martha; Vasanawathana, Sirijitt; et al. . Journal of Virology. January 2011, 85 (1): 410–421. PMC 3014204
 . PMID 20980526. doi:10.1128/JVI.01826-10.
. PMID 20980526. doi:10.1128/JVI.01826-10. - Wanwisa Dejnirattisai; Juthathip Mongkolsapaya; Wiyada Wongwiwat; Sunpetchuda Supasa; Xiaokang Zhang; Xinghong Dai; Alexander Rouvinski; Amonrat Jumnainsong; Carolyn Edwards; Nguyen Than Ha Quyen; Thaneeya Duangchinda; Jonathan M Grimes; Wen-Yang Tsai; Chih-Yun Lai; Wei-Kung Wang; Prida Malasit; Jeremy Farrar; Cameron P Simmons; Z Hong Zhou; Felix A Rey; Gavin R Screaton. . Nature Immunology. 2015, 16 (2): 170–177 [2018-05-25]. PMC 4445969
 . doi:10.1038/ni.3058. (原始内容存档于2019-09-13).
. doi:10.1038/ni.3058. (原始内容存档于2019-09-13). - Kim, J.H.; Skountzou, I.; Compans, R.; Jacob, J. . Journal of Immunology. 1 September 2009, 183 (5): 3294–301. PMC 4460008
 . PMID 19648276. doi:10.4049/jimmunol.0900398.
. PMID 19648276. doi:10.4049/jimmunol.0900398. - McMichael AJ. . Nature. 1998, 394 (6692): 421–422. PMID 9697760. doi:10.1038/28738.
- Juthathip Mongkolsapaya. . J. Immunol. 2006, 176 (6): 3821–3829. doi:10.4049/jimmunol.176.6.3821.