氟硅酸铵
氟矽酸銨或稱六氟硅酸铵,是一種白色的結晶體[5] ,分子式為(NH4)2[SiF6]。和其它氟硅酸盐一样,氟硅酸铵有毒。[6]氟硅酸铵至少有三种同质异形体[7],并在自然界中以稀有矿物方氟硅铵石或氟硅铵石的形式出现。
| 氟硅酸铵 | |
|---|---|
 | |
| IUPAC名 Ammonium fluorosilicate | |
| 别名 | 氟硅化铵;硅氟化铵;六氟硅酸铵 |
| 识别 | |
| CAS号 | 16919-19-0 |
| PubChem | 28145 |
| ChemSpider | 26182 |
| SMILES |
|
| InChI |
|
| InChIKey | ITHIMUMYFVCXSL-SKRXCDHZAK |
| UN编号 | 2854 |
| EINECS | 240-968-3 |
| RTECS | VV7800000 |
| 性质 | |
| 化学式 | (NH4)2[SiF6] |
| 外观 | 无色至白色晶体[1] |
| 密度 | 2.01 g cm−3[1] |
| 熔点 | 100 °C(373 K)(分解[2]) |
| 溶解性(水) | 186 g/L 当 17℃[1] |
| 溶解性 | 可溶于醇 |
| 危险性[3][4] | |
GHS危险性符号   | |
| GHS提示词 | DANGER |
| H-术语 | H301, H311, H315, H319, H331, H335, H372 |
| P-术语 | P260, P261, P264, P270, P271, P280, P301+310, P302+352, P304+340, P305+351+338, P312, P314, P321, P330 |
| NFPA 704 |
 0
3
0
ACID
|
| 相关物质 | |
| 其他阳离子 | 氟硅酸 氟硅酸钠 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
结构
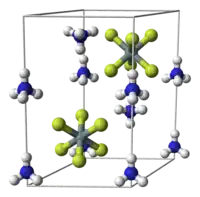
氟硅酸铵有三种主要的同质异形体。α-(NH4)2[SiF6] 是立方晶系的,空间群 Fm3m (No. 225),对应的矿物是方氟硅铵石。β相的氟硅酸铵则是三方晶系的,在自然中以氟硅铵石矿物的形式存在。[9]第三种同质异形体——γ相于2001年被发现,为六方晶系。这三种同质异形体的 [SiF6]2− 八面体都以层状排列。在α相中,这些层都和[111]方向垂直。在β和γ相中,这些层垂直于c轴。[7]α-(NH4)2[SiF6]的硅原子是面心立方堆积 (CCP)的,γ相为六方密堆积,而 β-(NH4)2[SiF6] 是原始六方堆积的。[10]三种相态的 (NH4)+周围都有十二个氟原子。[7]
尽管氟硅铵石在室温下是亚稳态,[11]它似乎不会变成另一个同质异形体。[7]尽管如此,氟硅铵石还是很脆弱的,将它研磨会产生一点的方氟硅铵石。[12]在 0.2 至0.3 GPa的压力下,方氟硅铵石会不可逆转变为氟硅铵石。[13]
(NH4)2[SiF6] 中的氢键允许氟硅酸铵通过普通盐不能的方式改变相态。阳离子和阴离子之间的相互作用在铵盐的相态改变中尤为重要。[7]
化学性质和危險性
虽然氟硅酸铵不可燃,但它在火中仍会释放危险的烟雾,例如氢氟酸、四氟化硅和氮氧化物。它也会腐蚀铝。氟硅酸铵可溶于水,形成酸性溶液。[5]
氟矽酸銨有毒,对眼睛、皮肤和上呼吸道有强烈刺激作用,另外如果不慎食入,短期症狀會造成口腔、咽喉、鼻烧伤并出血,而食入2~5g會致死。[15]
用处
氟硅酸铵可用作消毒剂,也用于蚀刻玻璃、金属铸造和电镀。[5]作为一种洗衣酸,氟硅酸铵也可以用来中和洗衣机的水。
参考文献
- Record of Ammoniumhexafluorosilikat in the GESTIS Substance Database from the IFA
- . [2021-11-26]. (原始内容存档于2011-09-30).
- . PubChem. National Institute of Health. [October 12, 2017]. (原始内容存档于2021-11-26).
- . Fisher Scientific. [October 15, 2017]. (原始内容存档于2017-10-16).
- Ammonium fuorosilicate (页面存档备份,存于), CAMEO Chemicals, NOAA
- Wiberg, E., Wiberg, N., and Holleman, A. F. (2001) Inorganic chemistry. Academic Press, San Diego.
- Boldyreva, E. V.; Shakhtshneider, T. P.; Sowa, H.; Ahsbas, H. . Zeitschrift für Kristallographie. 2007, 222: 23–29. doi:10.1524/zkri.2007.222.1.23.
- NLM Hazardous Substances Data Bank entry for AMMONIUM SILICOFLUORIDE
- Anthony, J. W., Bideaux, R. A., Bladh, K. W., and Nichols, M. C. (1997) Handbook of Mineralogy, Volume III: Halides, Hydroxides, Oxides. Mineral Data Publishing, Tucson.
- link to bararite (页面存档备份,存于)
- link to cryptohalite (页面存档备份,存于)
- To learn about the primitive hexagonal structure, see Primitive hexagonal packing 的存檔,存档日期2009-05-26..
- Schlemper, Elmer O. . The Journal of Chemical Physics. 1966, 44 (6): 2499. doi:10.1063/1.1727071.
- Oxton, I. A., Knop, O., and Falk, M. (1975) "Infrared Spectra of the Ammonium Ion in Crystals". II. The Ammonium Ion in Trigonal Environments, with a Consideration of Hydrogen Bonding. Canadian Journal of Chemistry, 53, 3394–3400.
- Elena V. Boldyreva, Tatyana P. Shakhtshneider, Heidrun Sowa, Hans Ahsbahs: Effect of hydrostatic pressure up to 6 GPa on the crystal structures of ammonium and sodium hexafluorosilicates, (NH4)2SiF6 and Na2SiF6; a phase transition in (NH4)2SiF6 at 0.2–0.3 GPa. In: Zeitschrift für Kristallographie, 2007, Band 222, Heft 1, S. 23–29 doi:10.1524/zkri.2007.222.1.23.
- Barnes, J. and Lapham, D. (1971) "Rare Minerals Found in Pennsylvania". Pennsylvania Geology, 2, 5, 6–8.
- . 21世纪实验室. [2008-04-19].