氧化加成
說明
氧化加成反應中,參與反應的配合物其中心金屬有空軌域且氧化態較低,氧化的方式則是增加一個和中心金屬鍵結的共價鍵(X-Y)。反應之後,金屬的形式氧化態 n 和配合物的電子個數皆加 2。[4] 雖然加入各種不同的共價鍵都會產生氧化加成反應,最常見的是加入 H-H 及碳(sp3)-鹵素鍵。sp2 混成的碳(如乙烯基),也出現在氧化加成反應。
還原消除反應是氧化加成反應的逆反應。[5] 反應之後產生 X-Y 化合物,若新形成的 X-Y 鍵度強度較強,反應會往還原消除反應的方向移動。不過 X 和 Y 原來需要在相鄰的位置和中心金屬原子配位,才會產生還原消除反應。
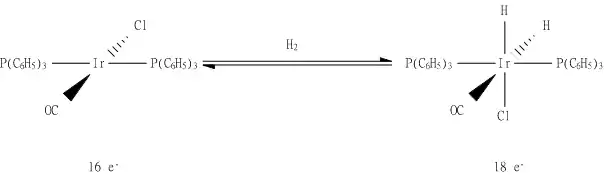
以下用Vaska配合物, trans-IrCl(CO)[P(C6H5)3]2 和氫的反應來說明氧化加成反應。此反應的生成物配體中有三個陰離子:Cl−及二個H−,因此可看出中心金屬被氧化,由 Ir(I) 變成 Ir(III)。反應物的金屬配合物有16個價電子,其配位數為4,而反應後有18個價電子,其配位數為6。此反應也可以以逆反應進行,反應物失去氫,而金屬配合數被還原,即為還原消除反應。
氧化加成反應及還原消除反應出現在許多有催化劑參與的反應中,如有使用威爾金森催化劑(Wilkinson's catalyst)的蒙山都法及烯的氫化反應。
參考
- The Organometallic Chemistry of Transition Metals by Robert Crabtree
- Inorganic Chemistry (3rd Edition) by Gary L. Miessler, Donald A. Tarr
- Inorganic Chemistry by D. F. Shriver, P. W. Atkins
- Compendium of Chemical Terminology, oxidative addition (页面存档备份,存于) accessed 6 Feb 2007.
- Compendium of Chemical Terminology, reductive elimination (页面存档备份,存于) accessed 6 Feb 2007.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.