氧化磷酸化
氧化磷酸化(英語:,縮寫作 OXPHOS)是细胞的一种代谢途径,该过程在真核生物的线粒体内膜或原核生物的细胞膜上发生,使用其中的酶及氧化各类营养素所释放的能量来合成三磷酸腺苷(ATP)。虽然地球上的生物消耗的能源物质范围极广,为合成代谢直接提供能量的分子却几乎都是ATP。几乎所有的好氧性生物都以三羧酸循环-氧化磷酸化作为制造ATP的主要过程。该途径如此普遍的原因可能是:与其他的代谢途径,特别是糖酵解之类的无氧发酵途径相比,它能更高效地释放能量。

氧化磷酸化期间,电子在氧化还原反应中从电子供体转移到电子受体,例如氧。氧化还原反应所释放的能量用于合成ATP。在真核生物中,这些氧化还原反应在一系列线粒体内膜上的蛋白质复合体的参与下完成,而在原核生物中,这些蛋白质存在于细胞膜间隙中。这一串蛋白质称为电子传递链。真核生物包含五种主要的蛋白质复合体,而原核生物中存在许多不同的酶,以便利用各种电子供体和受体。
在“电子传递”过程中,质子被电子流过电子传递链所释放的能量泵出线粒体内膜。这会以pH梯度和跨膜电势差的形式产生势能。储存的能量通过让质子顺梯度跨膜内流,由称为ATP合酶的大型酶所使用;这个过程称为化学渗透。这种酶在磷酸化反应过程中就像一台机械马达,酶的一部分在质子流的驱动下不停旋转,将二磷酸腺苷(ADP)合成为三磷酸腺苷。
虽然氧化磷酸化是新陈代谢的重要组成部分,它却会产生活性氧如超氧化物和过氧化氢,使自由基扩散开来,破坏细胞及造成病变,还有可能导致老化。该代谢途径中的酶也是许多药物和毒物所抑制的目标。
通过化学渗透转移能量的概述
氧化磷酸化的工作原理是利用释放能量的化学反应来驱动需要能量的反应:这样的反应称为是偶联反应。电子在电子传递链上从电子供体(如NADH)到电子受体(如氧)的流动,是一个放能的过程,而ATP的合成是一个耗能的过程,需要输入能量。电子传递链和ATP合酶都在膜中,在称为“化学渗透”的过程中,通过质子穿过这层膜的运动,将能量从电子传递链转移到ATP合酶中[1]。实际上,这就像一个简单的电路,质子通过电子传递链中的质子泵酶,从膜带负电位的N端流向带正电位的P端。这些酶如同其中的电池,做功来驱动电流在回路中流动。质子的移动产生了跨膜电化学梯度,这通常称为“质子动力”。它包含两部分:质子浓度差(H+梯度,ΔpH)和电势差,其中N端有负电荷[2]。
ATP合酶接通电路,让质子顺着电化学梯度流动,回到膜的N端,从中释放储存的能量[3]。这动能驱动着酶的部分结构旋转,并与ATP的合成相偶联。
质子动力的两种组分在热力学上是等效的:在线粒体中,大部分能量由电势差提供;在嗜碱性细菌中,电能甚至要补偿pH逆差造成的反作用。与之相反,叶绿体主要依靠ΔpH工作。然而,因为ATP合成的动力学要求,它们也需要一个小的膜电位。至少在梭杆菌P. modestum的情况中,它驱动ATP合酶FO转子的a、c亚基逆向旋转[2]。
与通过厌氧发酵产生的能量相比较,通过氧化磷酸化释放的能量很多。糖酵解只产生2个ATP分子,而通过将一分子葡萄糖转变为二氧化碳和水而生成的10个NADH和两分子琥珀酸氧化磷酸化,可以产生30到36个ATP[4]。以上的ATP产量均为理论最大值;在实际中,一些质子会发生跨膜泄漏,从而降低了ATP的产量[5]。
电子和质子的转移分子
电子传递链能承载质子和电子,将电子从供体转移到受体,并在膜间搬运质子。这些过程会使用可溶性的蛋白质结合转移分子。在线粒体中,电子在膜间隙内由水溶性电子传递蛋白细胞色素c传递[6]。它通过其结构中血红素基团的一个铁原子的还原和氧化过程传输电子。在某些细菌的周质空间中也发现了细胞色素c[7]。
线粒体内膜中的脂溶性电子载体辅酶Q10(Q)通过氧化还原循环,可同时携带电子和质子[8]。这个小苯醌分子疏水性很强,所以它能自由地在膜中扩散。当Q接受两个电子和两个质子时,它被还原为“泛酚”形式(QH2);当QH2释放两个电子和两个质子时,它被氧化为“泛醌”(Q)形式。结果,如果安排两种酶,使得Q在膜的一侧被还原,而QH2在另一侧被氧化,泛醌就能耦合这些反应,并携带质子穿过膜[9]。除了泛醌,一些细菌在电子传递链中还使用其他的醌类,如甲萘醌[10]。
在蛋白质中,电子在黄素辅因子[3][11]、铁硫簇和细胞色素之间转移。有几种类型的铁硫簇化合物。在电子传递链中发现的最简单的一种包含了由两个无机硫原子连接的两个铁原子;这些称为[2Fe-2S]簇。第二种称为[4Fe-4S],包含了由四个铁原子和四个硫原子组成的立方体。在这些簇中,每个铁原子与一个额外的氨基酸配位,通常是半胱氨酸中的硫原子。金属离子辅因子在氧化还原反应中不结合或释放质子,因此在电子传递链中都只通过蛋白质传输电子。电子沿着这些辅因子链跳跃,在蛋白质中移动很长的距离[12]。这些现象的本质是量子隧穿效应,在小于1.4×10−9米的距离内非常迅速[13]。
真核生物的电子传递链
许多生化代谢过程,如糖酵解、三羧酸循环和β氧化,都会产生还原型辅酶NADH。此辅酶含有高电极电势的电子;也就是说,它们将在氧化时释放出大量的能量。然而,细胞不会一次性释放完全部的能量,因为在这种情况下,反应将无法控制。相反,电子从NADH释放出来,并通过一系列的酶传递给氧气,其中每步只释放少量的能量。由复合体I到IV组成的这组酶称为电子传递链,存在于线粒体内膜中。琥珀酸也被电子传递链氧化,但起点不同。
真核生物中,电子传递系统中的酶用从氧化NADH释放的能量,泵送质子穿过线粒体内膜。这会使质子在膜间隙中积聚,产生跨膜电化学梯度。然后,ATP合酶使用存储在其中的势能以产生ATP。其中,真核细胞线粒体中的氧化磷酸化是这一过程研究最为透彻的样例。线粒体存在于几乎所有的真核生物中,但部分原生生物例外,如阴道毛滴虫中称为氢化酶体的残留线粒体会将质子还原为氢[14]。
| 呼吸酶 | 氧化还原对 | 中点电位(伏) |
|---|---|---|
| NADH脱氢酶 | NAD+ / NADH | −0.32[15] |
| 琥珀酸脱氢酶 | FMN或FAD / FMNH2或FADH2 | −0.20[15] |
| 细胞色素bc1复合体 | 辅酶Q10ox / 辅酶Q10red | +0.06[15] |
| 细胞色素bc1复合体 | 细胞色素box / 细胞色素bred | +0.12[15] |
| 复合体IV | 细胞色素cox / 细胞色素cred | +0.22[15] |
| 复合体IV | 细胞色素aox / 细胞色素ared | +0.29[15] |
| 复合体IV | O2 / HO− | +0.82[15] |
| 条件:pH = 7[15] | ||
NADH-辅酶Q氧化还原酶(复合体I)
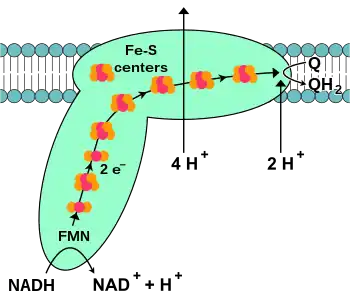
NADH-Q还原酶,又称“NADH脱氢酶”或“复合体I”,是电子传递链中的第一个蛋白[16]。它是一个巨大的酶,在哺乳动物中该复合体由46亚基组成,有1000千道尔顿(kDa)[17]。目前只了解一种细菌的复合体详细结构[18][19];大多数生物的复合体酷似有一个大“球”的靴子,从膜中穿到线粒体[20][21]。编码单个蛋白质的基因同时包含在细胞核和线粒体基因组中,许多线粒体酶都是这种情况。
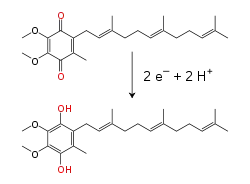
此酶催化的反应为NADH被辅酶Q10,即线粒体膜上的一种脂溶性醌类“泛醌”(在下面公式中写作Q)所氧化,同时转移两个电子:
这个反应乃至于整个电子链,是从NADH分子与复合体I结合及放出两个电子而开始。电子通过附着在其上的黄素单核苷酸(FMN)辅基进入复合体I。电子的加入使FMN转换为它的还原形式,FMNH2。电子随后通过一系列存在于复合体中的第二种辅基铁硫簇转移[18]。复合体I中存在两种铁硫簇,[2Fe-2S]和[4Fe-4S]。
电子穿过复合体时,有4个质子从基质泵入膜间隙。尚不清楚其中的机制,但似乎与复合体I的构象改变有关,这可使该蛋白质在膜的N侧结合质子,并在P侧释放它们[22]。最后,电子从铁硫簇链转移到膜中的泛醌分子上[16]。泛醌的还原也有助于质子梯度的产生,因为基质中的两个质子被用于泛酚(QH2)的还原。
琥珀酸-Q氧化还原酶(复合体II)
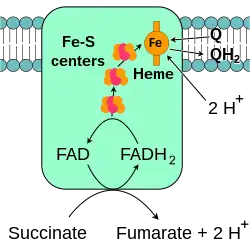
琥珀酸-Q氧化还原酶,又称“复合体II”或“琥珀酸脱氢酶”,是电子传递链的第二个入口[23]。它很特别,因为它是唯一一个既属于三羧酸循环、又属于电子传递链的酶。复合体II包含四个蛋白质亚基,一个附着的黄素腺嘌呤二核苷酸(FAD)辅因子,铁硫簇,和一个不参与将电子转移到辅酶Q、但被认为在降低氧化物活性上起重要作用的血红素基团[24][25]。它将琥珀酸氧化为延胡索酸,将泛醌还原。该反应释放的能量比氧化NADH少,因此复合体II不运输质子穿过膜,不会影响质子梯度。
一些真核生物,如寄生虫猪蛔虫,有类似复合体II的延胡索酸还原酶(甲基萘醌:延胡索酸氧化还原酶,又称QFR),但功能相反,其氧化泛醌而还原延胡索酸。这使蠕虫可以在大肠的厌氧环境中生活,将延胡索酸作为电子受体进行厌氧氧化磷酸化[26]。复合体II的另一种非常规功能在引起疟疾的寄生虫“恶性疟原虫”中得到体现。在这里作为氧化酶,复合体II的逆作用对泛酚的再生很重要,寄生虫将其用于一个不寻常的生物合成嘧啶的方式[27]。
电子传递黄素蛋白-Q氧化还原酶
电子传递黄素蛋白-泛醌氧化还原酶(ETF-Q氧化还原酶),又称“电子传递-黄素蛋白脱氢酶”,是电子传递链的第三个入口。它是接收线粒体基质中电子传递黄素蛋白的电子,并用这些电子还原泛醌的酶[28]。这种酶包含一个黄素和一个[4Fe-4S]簇,但不像其它的呼吸链复合体,它只附着在膜的表面,不跨越脂质双分子层[29]。
哺乳动物中,该代谢途径在脂肪酸的β氧化和氨基酸及胆碱的分解代谢作用中很重要,因为它接受来自多个乙酰辅酶A脱氢酶的电子[30][31]。在植物中,ETF-Q氧化还原酶也对使植物可以在长时间的黑暗中生存下来的代谢反应重要[32]。
Q-细胞色素c氧化还原酶(复合体III)
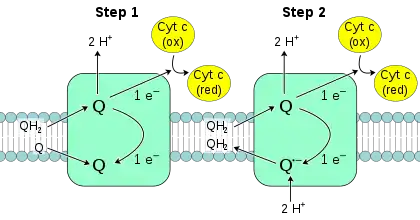
Q-细胞色素c氧化还原酶又称“细胞色素c还原酶”、“细胞色素bc1复合体”,或简称“复合体III”[33][34]。在哺乳动物中,这种酶是一个二聚体,每个亚基包含11个蛋白质亚基,1个[2Fe-2S]铁硫簇和3个细胞色素:1个细胞色素c1和2个细胞色素b[35]。细胞色素是一种传输电子的蛋白,包含至少一个血红素基团。当电子通过蛋白传递时,复合体III中血红素基团内的铁原子在还原型二价铁(+2)和氧化型三价铁(+3)之间切换。
复合体III催化的反应是一分子泛酚的氧化和两分子细胞色素c的还原,血红素蛋白部分与线粒体相关。不同于辅酶Q携带两个电子,细胞色素c只携带一个电子。
作为反应中唯一可将电子从QH2供体转移到细胞色素c受体的物质,复合体Ⅲ的反应机理较其他呼吸复合物认识更为详尽,其包含两个步骤,称作Q循环[36]。首先在第一步中,酶与三个QH2底物结合,然后将其氧化,并将所产生的一个电子传递到第二个底物细胞色素C。QH2所释放的两个质子被传递到膜间隙。第三个底物Q接受来自QH2的第二个电子,而还原为泛半醌自由基Q.-。先前的两个底物被释放,但这个泛半醌中间体仍然被酶所结合。第二步中,第二个QH2分子与酶结合,再一次将它的第一个电子传递给细胞色素c受体。结合的泛半醌得到第二个电子,并获得线粒体基质中的两个质子,而还原为QH2。这个QH2随后被酶释放[37]。
当辅酶Q在膜的内侧还原为泛酚,而在另一面氧化为泛醌时,质子的跨膜净转移随之发生,从而增加了质子梯度[3]。通过相当复杂的两步机制完成反应是重要的,因为它增加了质子转移的效率。如果替换Q循环,直接用一个QH2分子来还原两个细胞色素c分子,则每还原一个细胞色素c只能传送一个质子,效率将会减半[3]。
细胞色素c氧化酶(复合体IV)

细胞色素c氧化酶,又称“复合体IV”,是在电子传递链的最后一个蛋白质复合体[38]。哺乳动物的酶有极其复杂的结构,包含13个亚基,2个血红素基团,以及多种金属离子辅因子——总计3个铜原子,1个镁原子和1个锌原子[39]。
这种酶承载了电子传递链的最终反应,在跨膜泵送质子时将电子转移到氧上[40]。这一步,氧作为最终电子受体,也称“末端电子受体”,被还原为水。直接泵送的质子和在氧的还原中消耗的基质中质子都能影响质子梯度。所催化的反应为细胞色素c的氧化及氧的还原:
替代的还原酶和氧化酶
许多真核生物的电子传递链中的酶与上述研究较多的哺乳动物有所不同。例如,植物有替代的NADH氧化酶,可以不在线粒体基质而在细胞质中氧化NADH,并将这些电子传递到泛醌池[41]。这些酶不传送子,可在不改变跨膜电化学梯度时还原泛醌[42]。
分岔电子传递链的另一个例子是“替代氧化酶”,存在于植物、一些真菌及原生生物中,一些动物也可能包含其中[43][44]。这种酶可直接将泛酚中的电子转移到氧[45]。
通过这些替代NADH和泛醌氧化酶的电子传递途径比完整路径的ATP产量低。这些捷径的优点尚不明确。然而,替代氧化酶产生于应激反应,如受寒、活性氧、病原体感染,及其他抑制完整电子传递链的因素[46][47]。因此,替代途径可能可以通过减少氧化应激,从而提高生物对伤害的抵抗力[48]。
原核生物的电子传递链
虽然结构和功能与真核生物中的电子传递链相似,细菌和古菌的电子传递酶种类更为繁多。它们也拥有种类同样繁多的化学物质作为底物[55]。与真核生物相同,原核生物的电子传递使用氧化底物所释放的能量泵送离子跨膜,以产生电化学梯度。细菌中,对大肠杆菌的氧化磷酸化最为了解,而古菌中的这个过程目前仍知之甚少[56]。
真核生物和原核生物氧化磷酸化过程的主要区别是,细菌和古菌使用许多不同的物质以提供或接受电子。这使得原核生物可以在各种环境中生活[57]。例如在大肠杆菌中,许多还原剂和氧化剂对都可以驱动氧化磷酸化,如下所示。化学物质的中点电位可以衡量其被氧化或还原时所释放的能量,其中还原剂具有负电位,氧化剂具有正电位。
| 呼吸酶 | 氧化还原对 | 中点电位(伏) |
|---|---|---|
| 甲酸脱氢酶 | 碳酸氢盐 / 甲酸盐 | |
| 氢化酶 | 质子 / 氢 | |
| NADH脱氢酶 | NAD+ / NADH | |
| 甘油-3-磷酸脱氢酶 | DHAP / Gly-3-P | |
| 丙酮酸氧化酶 | 醋酸盐 + 二氧化碳 / 丙酮酸盐 | |
| 乳酸脱氢酶 | 丙酮酸盐 / 乳酸盐 | |
| D-氨基酸脱氢酶 | 2-含氧酸 + 氨 / D-氨基酸 | |
| 葡萄糖脱氢酶 | 葡萄糖酸盐 / 葡萄糖 | |
| 琥珀酸脱氢酶 | 延胡索酸盐 / 琥珀酸盐 | |
| 泛酚氧化酶 | 氧 / 水 | |
| 硝酸盐还原酶 | 硝酸盐 / 亚硝酸盐 | |
| 亚硝酸盐还原酶 | 亚硝酸盐 / 氨 | |
| 二甲基亚砜还原酶 | DMSO / DMS | |
| 氧化三甲胺还原酶 | TMAO / TMA | |
| 延胡索酸还原酶 | 延胡索酸盐 / 琥珀酸盐 |
如上所示,大肠杆菌可以在有还原剂如甲酸盐、氢或乳酸作为电子供体,及硝酸盐、DMSO、或氧气作为受体的条件下生活[57]。氧化剂和还原剂之间的中点电位差异越大,它们发生反应时就能释放更多的能量。这些化合物中,琥珀酸盐/延胡索酸盐对较特别,因为它的中点电位接近于零。琥珀酸盐因此可以在有强氧化剂的条件下氧化成延胡索酸盐,如氧,或者延胡索酸盐在有强还原剂的条件下还原成琥珀酸盐,如甲酸盐。这些替代反应分别由琥珀酸脱氢酶和延胡索酸还原酶催化[59]。
一些原核生物使用较小中间电位差的氧化还原对。例如,硝化细菌如硝化杆菌将亚硝酸盐氧化为硝酸盐,将电子传给氧气。反应中释放的少量能量就足以泵送质子以产生ATP,但还不足以直接产生同化作用所需的NADH或NADPH[60]。通过使用亚硝酸盐还原酶产生足够的质子动力,让电子传递链的一部分反向运行,使复合体I生成NADH,从而解决了此问题[61][62]。
原核生物可变换其产生的酶,控制电子供体和受体的使用,以适应环境条件的改变[63]。 因为不同的氧化酶和还原酶都使用相同的泛醌池,使其有一定的灵活性。由共同的泛醌中间体建立联系,酶的不同组合可以一起发挥作用[58]。呼吸链的模块化设计使其拥有多套可交换的酶系统。
除了代谢的多样性,原核生物也具有一系列的同工酶——可催化相同反应的不同酶。例如大肠杆菌有两种不同类型的泛酚氧化酶,都用氧作为电子受体。在氧充足的条件下,细菌会使用氧亲和性较低的氧化酶,其中每个电子可运送两个质子。但如果氧含量下降,它就能换用每个电子只能运送一个质子,但对氧有高亲合性的氧化酶[64]。
ATP合酶(复合体V)
ATP合酶,又称“复合体V”,是氧化磷酸化途径中的终点酶。无论在原核生物还是真核生物中,这种酶的形式和作用方式都相同[65]。它用存储在跨膜质子梯度的能量,驱动ADP和磷酸盐(Pi)合成ATP。合成一个ATP分子所需的质子数估计为为3至4个[66][67],有人认为细胞可以调节这一比例以适应不同的条件[68]。
这个磷酸化反应是个可逆反应,可以通过改变质子动力变换反应方向。在不存在质子动力时,ATP合酶的反应将向左运行,水解ATP及将质子从基质中跨膜泵出。然而当存在高质子动力时,反应将被强制反向进行;反应从左向右进行,允许质子顺浓度梯度流下,将ADP转化为ATP[65]。事实上,与此密切相关的液泡型H +-ATP酶可通过泵送质子和水解ATP,从而酸化细胞区室[69]。
ATP合酶是一个巨大的蛋白质复合体,呈蘑菇状。哺乳动物的酶复合体包含16个亚基,质量约为600千道尔顿[70]。嵌入在膜中的部分称为FO,包含一个c亚基环和质子通道。柄和球形头部称为F1,是ATP的合成位点。F1端部的球形复合体包含两种不同的六个蛋白(3个α亚基和3个β亚基),而“柄”包括一个蛋白:γ亚基,柄的前端延伸到球的α和β亚基[71]。α和β亚基都可与核苷酸结合,但只有β亚基可催化ATP的合成反应。与F1部分的一侧接触并延伸到膜背面的是一个长杆状的亚基,将α和β亚基固定在酶的基底上。
当质子穿过ATP合酶基底的通道跨膜时,FO上的质子驱动马达随之旋转[72]。转动的原因可能是由于c亚基环上的氨基酸电离变化,引起静电相互作用,从而推动c亚基环旋转[73]。旋转的环反过来驱动α和β亚基内的中心轴(γ亚基柄)旋转。作为定子的α和β亚基被侧臂固定以防止自身发生旋转。在由α和β亚基组成的球内,γ亚基顶部的运动为β亚基的活性部位提供了能量,使其周期性地产生并释放ATP[74]。
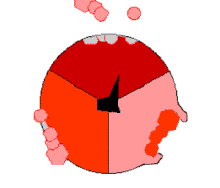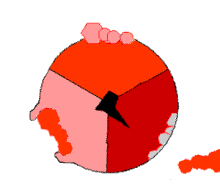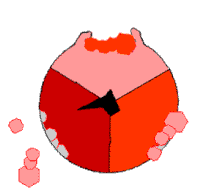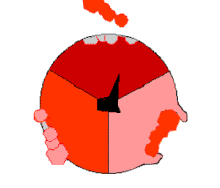
此ATP的合成反应称为结合能力机制,其中涉及β亚基活性位点在三种状态之间的循环[75]。在“空置”态,ADP和磷酸根进入活性位点(图中棕色所示)。然后蛋白质包围这些分子,并与之松散结合——是为“疏松结合”态(红色所示)。随后,酶再次改变形状,迫使这些分子结合在一起,在随后的“紧密结合”态(粉色所示)中,活性位点与新产生的极高亲和力ATP分子结合。最后,活性位点循环回空置态,释放出ATP并再次结合ADP和磷酸根,准备下一个循环。
在一些细菌和古菌中,ATP的合成是由钠离子的跨细胞膜移动所驱动,而不是质子的移动[76][77]。古菌如甲烷球菌也包含A1Ao合酶,其包含额外的蛋白质,亚基顺序与其他细菌和真核生物ATP合酶不相类似。也许在一些物种中,A1Ao的酶是一种特殊的钠驱动ATP合酶[78],但可能在其他情况下并不总是正确的[77]。
活性氧物质
氧分子是强氧化剂,因而是一种理想的末端电子受体。但氧的还原过程涉及有潜在危害的中间体[79]。虽然四个电子和四个质子的转移而将氧还原为水的反应是无害的,一个或两个电子的转移会产生超氧或过氧阴离子,这是危险的反应。
这些活性氧和它们的反应产物,如羟基自由基,对细胞非常有害,因为它们能氧化蛋白质并导致DNA突变。细胞的损伤可能会诱发疾病,并可能是导致老化的原因之一[80][81]。
细胞色素c氧化酶复合体能高效地将氧还原为水,且只释放极少量的部分还原中间体;然而,电子传递链却会产生少量的超氧阴离子和过氧化物[82]。其中尤为重要的是辅酶Q在复合体III中的还原过程,因为作为一种中间体,高活性的泛半醌自由基会在Q循环中生成。这种不稳定的物质可能会导致电子的“泄漏”,从而直接将电子传递到氧,形成超氧化物[83]。由于在高膜电位时,这些质子泵复合物生成活性氧物质的速度最快,有人认为线粒体能调节自己的活动,使膜电位维持在一个狭窄的范围内,以此平衡氧化剂和ATP的生成[84]。例如,氧化剂可以激活解偶联蛋白,从而降低膜电位[85]。
为了清除活性氧,细胞有一套复杂的抗氧化剂体系,包括抗氧化维生素如维生素C和维生素E,抗氧化酶如超氧化物歧化酶、过氧化氢酶和过氧化物酶[79],它们能消除活性物质的毒性,减小对细胞的损伤。
抑制剂
一些广为人知的药物和毒素可以抑制氧化磷酸化。尽管这些毒素的任何一个都只抑制电子传递链中的一个酶,抑制此过程中的任何步骤都将使其剩余部分停止运转。例如,如果寡霉素抑制了ATP合酶,质子就不能回流到线粒体内[86]。结果,质子泵就无法工作,因为梯度差太大以至于无法克服。然后,NADH不再被氧化,而因为NAD+浓度低于酶可用的浓度,三羧酸循环也随之停止运转。
| 化合物 | 作为 | 位置 | 效果 |
|---|---|---|---|
| 氰化物 一氧化碳 叠氮化物 硫化氢 |
毒素 | 复合体IV | 能比氧更强烈地结合细胞色素c氧化酶的铁铜中心,阻止氧的还原,从而抑制电子传递链。[87] |
| 寡霉素 | 抗生素 | 复合体V | 阻止质子流过Fo亚基,从而抑制ATP合酶。[86] |
| CCCP 2,4-二硝基苯酚 |
毒素,减肥[lower-alpha 5] | 内膜 | 携带质子跨膜的离子载体,从而破坏质子梯度。这种离子载体将质子泵与ATP合酶解耦,因为它能承载质子跨过线粒体内膜。[88] |
| 鱼藤酮 | 农药 | 复合体I | 阻断与泛醌结合的位点,从而阻止电子从复合体I转移到泛醌。[89] |
| 丙二酸盐和草酰乙酸 | 毒素 | 复合体II | 琥珀酸脱氢酶(复合体II)的竞争性抑制剂。[90] |
| 抗霉素A | 杀鱼剂 | 复合体III | 结合到细胞色素C还原酶的Qi位点,从而抑制泛醌醇的氧化。 |
并非所有的氧化磷酸化抑制剂都是毒物。在棕色脂肪组织里,称为解偶联蛋白的调节性质子通道可将呼吸作用与ATP合成解耦[91]。它能使呼吸作用快速产生热量,对冬眠动物和幼年哺乳动物来说,这对维持体温尤为重要,虽然这些蛋白质可能在细胞的应激反应中有更一般化的功能[92]。
历史
对氧化磷酸化的研究起源于阿瑟·哈登1906年的报告,阐述了磷酸盐在细胞发酵中的重要作用,但最初只知道糖磷酸盐与此相关[93]。然而在20世纪40年代初,糖的氧化和ATP的生成之间的联系被赫尔曼·卡尔卡牢牢确立[94],同时在1941年,弗里茨·阿尔伯特·李普曼确认ATP在能量传递中起核心作用[95]。后来在1949年,莫里斯·弗里德金与阿尔伯特·伦宁格证明,辅酶NADH与代谢途径如三羧酸循环及ATP的合成有关[96]。
又过了二十年,ATP的生成机制依然是个谜,同时科学家也在寻找那个难以捉摸的连接氧化与磷酸化反应的“高能中间体”[97]。这个难题在彼得·米切尔于1961年发表的化学渗透理论中得到了解决[98]。起初,这个看法极具争议,但随时间流逝,它逐渐为人们所接受,米切尔也于1978年获颁诺贝尔化学奖[99][100]。随后的研究集中于提纯和描述所涉及的酶,其中戴维·格林和埃夫拉伊姆·莱克分别对电子传递链上复合体和ATP合酶的研究作出了重大贡献[101]。解决ATP合酶机制的关键步骤由保罗·博耶1973年构想的“结合变构”机制所解释,随后是1982年他提出的旋转催化的激进想法[75][102]。较近期的工作包括由约翰·沃克完成的氧化磷酸化酶的结构研究。沃克和博耶于1997年被授予诺贝尔化学奖[103]。
参见
- 呼吸计量
- TIM/TOM复合体
注释
- ox:氧化型,red:还原型
- matrix:基质,intermembrane:膜间隙
- Succinate:琥珀酸,Fumarate:延胡索酸
- Superoxide:超氧化物,Peroxide:过氧化物
- 1930年时,DNP广泛用作抗肥胖药物,但因其危险的副作用最终被中止。然而,为此而非法使用该药物的行为一直延续到今天。参见2,4-二硝基苯酚#减肥用药。
参考文献
- Mitchell P, Moyle J; Moyle. . Nature. 1967, 213 (5072): 137–9. Bibcode:1967Natur.213..137M. PMID 4291593. doi:10.1038/213137a0.
- Dimroth P, Kaim G, Matthey U. . J. Exp. Biol. 1 January 2000, 203 (Pt 1): 51–9. PMID 10600673. (原始内容存档于2007年9月30日).
- Schultz B, Chan S. . Annu Rev Biophys Biomol Struct. 2001, 30: 23–65. PMID 11340051. doi:10.1146/annurev.biophys.30.1.23.
- Rich PR. . Biochem. Soc. Trans. 2003, 31 (Pt 6): 1095–105 [2014-04-25]. PMID 14641005. doi:10.1042/BST0311095. (原始内容存档于2019-09-12).
- Porter RK, Brand MD. . Biochem. J. 1995, 310 ((Pt 2)): 379–82. PMC 1135905
 . PMID 7654171.
. PMID 7654171. - Mathews FS. . Prog. Biophys. Mol. Biol. 1985, 45 (1): 1–56. PMID 3881803. doi:10.1016/0079-6107(85)90004-5.
- Wood PM. . FEBS Lett. 1983, 164 (2): 223–6. PMID 6317447. doi:10.1016/0014-5793(83)80289-0.
- Crane FL. . Journal of the American College of Nutrition. 1 December 2001, 20 (6): 591–8. PMID 11771674. doi:10.1080/07315724.2001.10719063. (原始内容存档于2014年5月30日).
- Mitchell P. . Science. 1979, 206 (4423): 1148–59. Bibcode:1979Sci...206.1148M. PMID 388618. doi:10.1126/science.388618.
- Søballe B, Poole RK. (PDF). Microbiology (Reading, Engl.). 1999, 145 (8): 1817–30. PMID 10463148. doi:10.1099/13500872-145-8-1817. (原始内容存档 (PDF)于2008-05-29).
- Johnson D, Dean D, Smith A, Johnson M. . Annu Rev Biochem. 2005, 74: 247–81. PMID 15952888. doi:10.1146/annurev.biochem.74.082803.133518.
- Page CC, Moser CC, Chen X, Dutton PL; Moser; Chen; Dutton. . Nature. 1999, 402 (6757): 47–52. Bibcode:1999Natur.402...47P. PMID 10573417. doi:10.1038/46972.
- Leys D, Scrutton NS. . Current Opinion in Structural Biology. 2004, 14 (6): 642–7. PMID 15582386. doi:10.1016/j.sbi.2004.10.002.
- Boxma B; de Graaf RM; van der Staay GW; Van Alen; Ricard; Gabaldón; Van Hoek; Moon-Van Der Staay; Koopman; Van Hellemond; Tielens; Friedrich; Veenhuis; Huynen; Hackstein; et al. . Nature. 2005, 434 (7029): 74–9. Bibcode:2005Natur.434...74B. PMID 15744302. doi:10.1038/nature03343.
- Medical CHEMISTRY Compendium. By Anders Overgaard Pedersen and Henning Nielsen. Aarhus University. 2008
- Hirst J. (PDF). Biochem. Soc. Trans. 2005, 33 (Pt 3): 525–9. PMID 15916556. doi:10.1042/BST0330525.
- Lenaz G, Fato R, Genova M, Bergamini C, Bianchi C, Biondi A. . Biochim Biophys Acta. 2006, 1757 (9–10): 1406–20. PMID 16828051. doi:10.1016/j.bbabio.2006.05.007.
- Sazanov, L.A.; Hinchliffe, P. . Science. 2006, 311 (5766): 1430–1436. Bibcode:2006Sci...311.1430S. PMID 16469879. doi:10.1126/science.1123809.
- Efremov R.G., Baradaran R., & Sazanov L.A., (2010) The arcdhitecture of respiratory complex I, Nature 465, 441-445
- Baranova EA, Holt PJ, Sazanov LA. . J. Mol. Biol. 2007, 366 (1): 140–54. PMID 17157874. doi:10.1016/j.jmb.2006.11.026.
- Friedrich T, Böttcher B. . Biochim. Biophys. Acta. 2004, 1608 (1): 1–9. PMID 14741580. doi:10.1016/j.bbabio.2003.10.002.
- Hirst J. . Biochem. J. January 2010, 425 (2): 327–39. PMID 20025615. doi:10.1042/BJ20091382.
- Cecchini G. . Annu Rev Biochem. 2003, 72: 77–109. PMID 14527321. doi:10.1146/annurev.biochem.72.121801.161700.
- Yankovskaya, V.; Horsefield, R.; Tornroth, S.; Luna-Chavez, C.; Miyoshi, H.; Leger, C.; Byrne, B.; Cecchini, G.; Iwata, S.; et al. . Science. 2003, 299 (5607): 700–704. Bibcode:2003Sci...299..700Y. PMID 12560550. doi:10.1126/science.1079605.
- Horsefield R, Iwata S, Byrne B. . Curr. Protein Pept. Sci. 2004, 5 (2): 107–18. PMID 15078221. doi:10.2174/1389203043486847.
- Kita K, Hirawake H, Miyadera H, Amino H, Takeo S. . Biochim. Biophys. Acta. 2002, 1553 (1–2): 123–39. PMID 11803022. doi:10.1016/S0005-2728(01)00237-7.
- Painter HJ, Morrisey JM, Mather MW, Vaidya AB; Morrisey; Mather; Vaidya. . Nature. 2007, 446 (7131): 88–91. Bibcode:2007Natur.446...88P. PMID 17330044. doi:10.1038/nature05572.
- Ramsay RR, Steenkamp DJ, Husain M. . Biochem. J. 1987, 241 (3): 883–92. PMC 1147643
 . PMID 3593226.
. PMID 3593226. - Zhang J, Frerman FE, Kim JJ; Frerman; Kim. . Proc. Natl. Acad. Sci. U.S.A. 2006, 103 (44): 16212–7. Bibcode:2006PNAS..10316212Z. PMC 1637562
 . PMID 17050691. doi:10.1073/pnas.0604567103.
. PMID 17050691. doi:10.1073/pnas.0604567103. - Ikeda Y, Dabrowski C, Tanaka K. . J. Biol. Chem. 25 January 1983, 258 (2): 1066–76. PMID 6401712. (原始内容存档于2007年9月29日).
- Ruzicka FJ, Beinert H. (PDF). J. Biol. Chem. 1977, 252 (23): 8440–5. PMID 925004. (原始内容存档 (PDF)于2007-09-27).
- Ishizaki K, Larson TR, Schauer N, Fernie AR, Graham IA, Leaver CJ. . Plant Cell. 2005, 17 (9): 2587–600. PMC 1197437
 . PMID 16055629. doi:10.1105/tpc.105.035162.
. PMID 16055629. doi:10.1105/tpc.105.035162. - Berry E, Guergova-Kuras M, Huang L, Crofts A. . Annu Rev Biochem. 2000, 69: 1005–75. PMID 10966481. doi:10.1146/annurev.biochem.69.1.1005.
- Crofts AR. . Annu. Rev. Physiol. 2004, 66: 689–733. PMID 14977419. doi:10.1146/annurev.physiol.66.032102.150251.
- Iwata S; Lee JW; Okada K; Kyongwon Lee; Iwata; Rasmussen; Link; Ramaswamy; Jap; et al. . Science. 1998, 281 (5373): 64–71. Bibcode:1998Sci...281...64I. PMID 9651245. doi:10.1126/science.281.5373.64.
- Trumpower BL. (PDF). J. Biol. Chem. 1990, 265 (20): 11409–12. PMID 2164001. (原始内容存档 (PDF)于2007-09-27).
- Hunte C, Palsdottir H, Trumpower BL. . FEBS Lett. 2003, 545 (1): 39–46. PMID 12788490. doi:10.1016/S0014-5793(03)00391-0.
- Calhoun M, Thomas J, Gennis R. . Trends Biochem Sci. 1994, 19 (8): 325–30. PMID 7940677. doi:10.1016/0968-0004(94)90071-X.
- Tsukihara T, Aoyama H, Yamashita E, Tomizaki T, Yamaguchi H, Shinzawa-Itoh K, Nakashima R, Yaono R, Yoshikawa S.; Aoyama; Yamashita; Tomizaki; Yamaguchi; Shinzawa-Itoh; Nakashima; Yaono; Yoshikawa. . Science. 1996, 272 (5265): 1136–44. Bibcode:1996Sci...272.1136T. PMID 8638158. doi:10.1126/science.272.5265.1136.
- Yoshikawa S; Muramoto K; Shinzawa-Itoh K; et al. . Biochim. Biophys. Acta. 2006, 1757 (9–10): 1110–6. PMID 16904626. doi:10.1016/j.bbabio.2006.06.004.
- Rasmusson AG, Soole KL, Elthon TE. . Annual review of plant biology. 2004, 55: 23–39. PMID 15725055. doi:10.1146/annurev.arplant.55.031903.141720.
- Menz RI, Day DA. . J. Biol. Chem. 1996, 271 (38): 23117–20. PMID 8798503. doi:10.1074/jbc.271.38.23117. (原始内容存档于2007-09-29).
- McDonald A, Vanlerberghe G. . IUBMB Life. 2004, 56 (6): 333–41. PMID 15370881. doi:10.1080/1521-6540400000876.
- Sluse FE, Jarmuszkiewicz W. . Braz. J. Med. Biol. Res. 1998, 31 (6): 733–47. PMID 9698817. doi:10.1590/S0100-879X1998000600003.
- Moore AL, Siedow JN. . Biochim. Biophys. Acta. 1991, 1059 (2): 121–40. PMID 1883834. doi:10.1016/S0005-2728(05)80197-5.
- Vanlerberghe GC, McIntosh L. . Annual Review of Plant Physiology and Plant Molecular Biology. 1997, 48: 703–34. PMID 15012279. doi:10.1146/annurev.arplant.48.1.703.
- Ito Y, Saisho D, Nakazono M, Tsutsumi N, Hirai A. . Gene. 1997, 203 (2): 121–9. PMID 9426242. doi:10.1016/S0378-1119(97)00502-7.
- Maxwell DP, Wang Y, McIntosh L; Wang; McIntosh. . Proc. Natl. Acad. Sci. U.S.A. 1999, 96 (14): 8271–6. Bibcode:1999PNAS...96.8271M. PMC 22224
 . PMID 10393984. doi:10.1073/pnas.96.14.8271. (原始内容存档于2007-05-16).
. PMID 10393984. doi:10.1073/pnas.96.14.8271. (原始内容存档于2007-05-16). - Lenaz G. . FEBS Lett. 2001, 509 (2): 151–5. PMID 11741580. doi:10.1016/S0014-5793(01)03172-6.
- Heinemeyer J, Braun HP, Boekema EJ, Kouril R. . J. Biol. Chem. 2007, 282 (16): 12240–8. PMID 17322303. doi:10.1074/jbc.M610545200.
- Schägger H, Pfeiffer K. . EMBO J. 2000, 19 (8): 1777–83. PMC 302020
 . PMID 10775262. doi:10.1093/emboj/19.8.1777.
. PMID 10775262. doi:10.1093/emboj/19.8.1777. - Schägger H. . Biochim. Biophys. Acta. 2002, 1555 (1–3): 154–9. PMID 12206908. doi:10.1016/S0005-2728(02)00271-2.
- Schägger H, Pfeiffer K. . J. Biol. Chem. 2001, 276 (41): 37861–7. PMID 11483615. doi:10.1074/jbc.M106474200. (原始内容存档于2007-09-29).
- Gupte S; Wu ES; Hoechli L; Hoechli; Jacobson; Sowers; Hackenbrock; et al. . Proc. Natl. Acad. Sci. U.S.A. 1984, 81 (9): 2606–10. Bibcode:1984PNAS...81.2606G. PMC 345118
 . PMID 6326133. doi:10.1073/pnas.81.9.2606.
. PMID 6326133. doi:10.1073/pnas.81.9.2606. - Nealson KH. . Origins of life and evolution of the biosphere: the journal of the International Society for the Study of the Origin of Life. 1999, 29 (1): 73–93. PMID 11536899. doi:10.1023/A:1006515817767.
- Schäfer G, Engelhard M, Müller V. . Microbiol. Mol. Biol. Rev. 1999, 63 (3): 570–620. PMC 103747
 . PMID 10477309.
. PMID 10477309. - Ingledew WJ, Poole RK. . Microbiol. Rev. 1984, 48 (3): 222–71. PMC 373010
 . PMID 6387427.
. PMID 6387427. - Unden G, Bongaerts J. . Biochim. Biophys. Acta. 1997, 1320 (3): 217–34. PMID 9230919. doi:10.1016/S0005-2728(97)00034-0.
- Cecchini G, Schröder I, Gunsalus RP, Maklashina E. . Biochim. Biophys. Acta. 2002, 1553 (1–2): 140–57. PMID 11803023. doi:10.1016/S0005-2728(01)00238-9.
- Freitag A, Bock E. . FEMS Microbiology Letters. 1990, 66 (1–3): 157–62. doi:10.1111/j.1574-6968.1990.tb03989.x.
- Starkenburg SR; Chain PS; Sayavedra-Soto LA; et al. . Appl. Environ. Microbiol. 2006, 72 (3): 2050–63. PMC 1393235
 . PMID 16517654. doi:10.1128/AEM.72.3.2050-2063.2006. (原始内容存档于2007-10-13).
. PMID 16517654. doi:10.1128/AEM.72.3.2050-2063.2006. (原始内容存档于2007-10-13). - Yamanaka T, Fukumori Y. . FEMS Microbiol. Rev. 1988, 4 (4): 259–70. PMID 2856189.
- Iuchi S, Lin EC. . Mol. Microbiol. 1993, 9 (1): 9–15. PMID 8412675. doi:10.1111/j.1365-2958.1993.tb01664.x.
- Calhoun MW, Oden KL, Gennis RB, de Mattos MJ, Neijssel OM. (PDF). J. Bacteriol. 1993, 175 (10): 3020–5. PMC 204621
 . PMID 8491720. (原始内容存档 (PDF)于2007-09-27).
. PMID 8491720. (原始内容存档 (PDF)于2007-09-27). - Boyer PD. . Annu. Rev. Biochem. 1997, 66: 717–49. PMID 9242922. doi:10.1146/annurev.biochem.66.1.717.
- Van Walraven HS, Strotmann H, Schwarz O, Rumberg B. . FEBS Lett. 1996, 379 (3): 309–13. PMID 8603713. doi:10.1016/0014-5793(95)01536-1.
- Yoshida M, Muneyuki E, Hisabori T. . Nature Reviews Molecular Cell Biology. 2001, 2 (9): 669–77. PMID 11533724. doi:10.1038/35089509.
- Schemidt RA, Qu J, Williams JR, Brusilow WS. . J. Bacteriol. 1998, 180 (12): 3205–8. PMC 107823
 . PMID 9620972.
. PMID 9620972. - Nelson N, Perzov N, Cohen A, Hagai K, Padler V, Nelson H. . J. Exp. Biol. 1 January 2000, 203 (Pt 1): 89–95. PMID 10600677. (原始内容存档于2007年9月30日).
- Rubinstein JL, Walker JE, Henderson R. . EMBO J. 2003, 22 (23): 6182–92. PMC 291849
 . PMID 14633978. doi:10.1093/emboj/cdg608.
. PMID 14633978. doi:10.1093/emboj/cdg608. - Leslie AG, Walker JE. . Philosophical Transactions of the Royal Society B. 2000, 355 (1396): 465–71. PMC 1692760
 . PMID 10836500. doi:10.1098/rstb.2000.0588.
. PMID 10836500. doi:10.1098/rstb.2000.0588. - Noji H, Yoshida M. . J. Biol. Chem. 2001, 276 (3): 1665–8. PMID 11080505. doi:10.1074/jbc.R000021200. (原始内容存档于2007-09-29).
- Capaldi R, Aggeler R. . Trends Biochem Sci. 2002, 27 (3): 154–60. PMID 11893513. doi:10.1016/S0968-0004(01)02051-5.
- Dimroth P, von Ballmoos C, Meier T. . EMBO Reports. 2006, 7 (3): 276–82. PMC 1456893
 . PMID 16607397. doi:10.1038/sj.embor.7400646.
. PMID 16607397. doi:10.1038/sj.embor.7400646. - Gresser MJ, Myers JA, Boyer PD. . J. Biol. Chem. 25 October 1982, 257 (20): 12030–8. PMID 6214554. (原始内容存档于2007年9月29日).
- Dimroth P. . Antonie Van Leeuwenhoek. 1994, 65 (4): 381–95. PMID 7832594. doi:10.1007/BF00872221.
- Becher B, Müller V. . J. Bacteriol. 1994, 176 (9): 2543–50. PMC 205391
 . PMID 8169202.
. PMID 8169202. - Müller V. . J. Bioenerg. Biomembr. 2004, 36 (1): 115–25. PMID 15168615. doi:10.1023/B:JOBB.0000019603.68282.04.
- Davies K. . Biochem Soc Symp. 1995, 61: 1–31. PMID 8660387.
- Rattan SI. . Free Radic. Res. 2006, 40 (12): 1230–8. PMID 17090411. doi:10.1080/10715760600911303.
- Valko M, Leibfritz D, Moncol J, Cronin MT, Mazur M, Telser J. . Int. J. Biochem. Cell Biol. 2007, 39 (1): 44–84. PMID 16978905. doi:10.1016/j.biocel.2006.07.001.
- Raha S, Robinson B. . Trends Biochem Sci. 2000, 25 (10): 502–8. PMID 11050436. doi:10.1016/S0968-0004(00)01674-1.
- Finkel T, Holbrook NJ. . Nature. 2000, 408 (6809): 239–47. PMID 11089981. doi:10.1038/35041687.
- Kadenbach B, Ramzan R, Wen L, Vogt S. . Biochim. Biophys. Acta. May 2009, 1800 (3): 205–212. PMID 19409964. doi:10.1016/j.bbagen.2009.04.019.
- Echtay KS; Roussel D; St-Pierre J; Jekabsons; Cadenas; Stuart; Harper; Roebuck; Morrison; Pickering; Clapham; Brand; et al. . Nature. January 2002, 415 (6867): 96–9. Bibcode:2002Natur.415...96E. PMID 11780125. doi:10.1038/415096a.
- Joshi S, Huang YG. . Biochim. Biophys. Acta. 1991, 1067 (2): 255–8. PMID 1831660. doi:10.1016/0005-2736(91)90051-9.
- Tsubaki M; Yoshikawa, Shinya. . Biochemistry. 1993, 32 (1): 164–73. PMID 8380331. doi:10.1021/bi00052a022.
- Heytler PG. . Meth. Enzymol. Methods in Enzymology. 1979, 55: 462–42. ISBN 978-0-12-181955-2. PMID 156853. doi:10.1016/0076-6879(79)55060-5.
- Lambert AJ, Brand MD. . J. Biol. Chem. 2004, 279 (38): 39414–20. PMID 15262965. doi:10.1074/jbc.M406576200. (原始内容存档于2007-09-29).
- Dervartanian DV, Veeger C. . Biochim. Biophys. Acta. November 1964, 92: 233–47. PMID 14249115. doi:10.1016/0926-6569(64)90182-8.
- Ricquier D, Bouillaud F. . Biochem. J. 2000, 345 (2): 161–79. PMC 1220743
 . PMID 10620491. doi:10.1042/0264-6021:3450161.
. PMID 10620491. doi:10.1042/0264-6021:3450161. - Borecký J, Vercesi AE. . Biosci. Rep. 2005, 25 (3–4): 271–86. PMID 16283557. doi:10.1007/s10540-005-2889-2.
- Harden A, Young WJ. . Proceedings of the Royal Society. 1906, B (77): 405–20. doi:10.1098/rspb.1906.0029.
- Kalckar HM. . Mol. Cell. Biochem. 1974, 5 (1–2): 55–63. PMID 4279328. doi:10.1007/BF01874172.
- Lipmann F,. . Adv Enzymol. 1941, 1: 99–162.
- Friedkin M, Lehninger AL. . J. Biol. Chem. 1 April 1949, 178 (2): 611–23. PMID 18116985. (原始内容存档于2008年12月16日).
- Slater EC. . Nature. 1953, 172 (4387): 975–8. Bibcode:1953Natur.172..975S. PMID 13111237. doi:10.1038/172975a0.
- Mitchell P. . Nature. 1961, 191 (4784): 144–8. Bibcode:1961Natur.191..144M. PMID 13771349. doi:10.1038/191144a0.
- Milton H. Saier Jr. . [2014-05-25]. (原始内容存档于2014-07-14).
- Mitchell, Peter. (Pdf). Nobel lecture. Nobel Foundation. 1978 [2007-07-21]. (原始内容存档 (PDF)于2007-09-27).
- Pullman ME, Penefsky HS, Datta A, and Racker E. . J. Biol. Chem. 1 November 1960, 235 (11): 3322–9. PMID 13738472. (原始内容存档于2007年9月29日).
- Boyer PD, Cross RL, Momsen W; Cross; Momsen. . Proc. Natl. Acad. Sci. U.S.A. 1973, 70 (10): 2837–9. Bibcode:1973PNAS...70.2837B. PMC 427120
 . PMID 4517936. doi:10.1073/pnas.70.10.2837.
. PMID 4517936. doi:10.1073/pnas.70.10.2837. - . Nobel Foundation. [2007-07-21]. (原始内容存档于2017-03-24).
扩展阅读
概论
外部链接
一般资料
- 氧化磷酸化的动画演示 (页面存档备份,存于),約翰威立《生物化学概念》
- 在线生物物理讲座 (页面存档备份,存于),安东尼·克罗夫茨(Antony Crofts), 伊利诺伊大学厄巴纳-香槟分校
- ATP合酶 (页面存档备份,存于),格雷厄姆·约翰逊(Graham Johnson)
- www.Atmungskette.de (精美显浅易懂的呼吸链讲解)
- Electron Transport Pathway--English (页面存档备份,存于)