水分子簇
水分子簇,又称水团簇、水簇、水分子团是一种不连续的氢键结构形成的水分子簇合物。[1]这些簇合物有的被实验所证实,有的通过理论计算推测存在。它们有多种存在的形式:在冰中、在晶格中以及在液态水中。其中最简单的就是二聚水(化学式:(H2O)2)。继续进行科学研究十分重要,因为这使人们意识到水能自发地形成簇合物,而不是各向同性的无序物质。这可能可以解释水的许多反常性质,例如其密度不完全遵守热胀冷缩的规律。水分子簇也与一些特定超分子结构的稳定性有关。人类目前对自由水中水分子簇的了解很少,因此这被认为是未解决的化学问题之一。
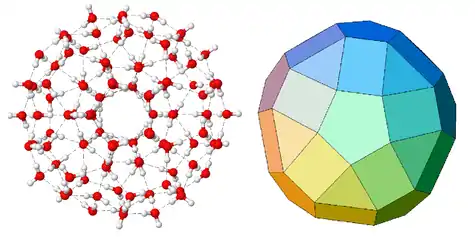
理论研究(计算得出的结构)
理论计算表明(参见:水模型),环状的水分子簇(H2O)n中n的值可以从3取到60。随着簇的体积增大,两个氧原子之间的距离会因为所谓的共同多体相互作用而减小。这是因为电荷分布发生变化造成氢受体分子成为一个更好的氢供体分子,同时导致水的总体积增大。六聚体中似乎存在多种同分异构体:环状的、书状的、包状的、笼状的、棱柱形的,它们的能量基本相同。七聚体和八聚体以笼状形式存在,还未发现环状或正方体形状的异构体。更大的簇合物也有研究,类似于富勒烯的(H2O)28,这被称为水布基球(water buckyball)。甚至一种由280个水分子组成的庞大的二十面体结构(每个水分子周围最近有4个水分子)也被发现处于局部势能极小值。这种结构的簇合物直径达到3纳米,由三个二十面体的层构成,每层分别有280个、100个和20个水分子(100个分子组成的结构见右上图)。每增加一层都使得簇合物的稳定性得到提高。[2]近期的研究文献对使用量子化学从头计算方法研究水分子簇有较好的评价。[3][4]
实验结构
实验观察[5][6]水分子簇需要精密的光谱仪器,例如远红外振动转动隧道光谱。将水分子困在液氦环境中,可以发现六聚体是一个平面环状结构,在气相中是笼状结构,而将液氦换成某些有机物,就会发现它的构象类似于熟悉的环己烷构象。结合红外光谱和质谱进行观测可以发现立方形的结构存在于8到10个水分子的簇合物中。
如果水是晶体结构的一部分(例如水合物),就可以通过X射线衍射进行研究。一项近期的研究就用此法发现一种水的七聚体是扭船型的非平面环状结构。[7]
参考资料
- Ralf Ludwig. . Angew. Chem. Int. Ed. 2001, 40 (10): 1808–1827. PMID 11385651. doi:10.1002/1521-3773(20010518)40:10<1808::AID-ANIE1808>3.0.CO;2-1.
- Loboda, Oleksandr; Goncharuk, Vladyslav. . Chemical Physics Letters: 144–147. Bibcode:2010CPL...484..144L. doi:10.1016/j.cplett.2009.11.025.
- S. Maheshwary, N. Patel, N Sathyamurthy, A. D. Kulkarni, S. R. Gadre. . J. Phys. Chem. a. 2001, 105 (46): 10525. doi:10.1021/jp013141b.
- G. S. Fanourgakis, E. Aprà, W. A. de Jong, S. S. Xantheas. . J. Chem. Phys. 2005, 122 (13): 134304. Bibcode:2005JChPh.122m4304F. PMID 15847462. doi:10.1063/1.1864892.
- C. J. Gruenloh, J. R. Carney, C. A. Arrington, T. S. Zwier, S. Y. Fredericks, K. D. Jordan. . Science. 1997, 276 (5319): 1678. doi:10.1126/science.276.5319.1678.
- M. R. Viant, J. D. Cruzan, D. D. Lucas, M. G. Brown, K. Liu, R. J. Saykally. . J. Phys. Chem. a. 1997, 101 (48): 9032. doi:10.1021/jp970783j.
- M. H. Mir, J. J. Vittal. . Angew. Chem. Int. Ed. 2007, 46 (31): 5925–5928. PMID 17577896. doi:10.1002/anie.200701779.
- Smith, Jared D.; Christopher D. Cappa, Kevin R. Wilson, Ronald C. Cohen, Phillip L. Geissler, Richard J. Saykally. (PDF). Proc. Natl. Acad. Sci. USA. 2005, 102 (40): 14171–14174 [2012-11-01]. Bibcode:2005PNAS..10214171S. PMC 1242322
 . PMID 16179387. doi:10.1073/pnas.0506899102. (原始内容 (PDF)存档于2018-11-01).
. PMID 16179387. doi:10.1073/pnas.0506899102. (原始内容 (PDF)存档于2018-11-01). - Borowski, Piotr; Jaroniec, Justyna; Janowski, Tomasz; Woliński, Krzysztof. . Molecular Physics. 2003, 101 (10): 1413. doi:10.1080/0026897031000085083.
- Lehmann, S. B. C.; Spickermann, C.; Kirchner, B. . Journal of Chemical Theory and Computation. 2009, 5 (6): 1640. doi:10.1021/ct800310a.
外部链接
- Water clusters at London South Bank University Link
- The Cambridge Cluster Database (页面存档备份,存于) - Includes water clusters calculated with various water models and the water clusters explored with ab initio methods (页面存档备份,存于).