沃尔-齐格勒溴化反应
沃尔-齐格勒溴化反应(Wohl–Ziegler bromination)[1][2]指自由基引发剂存在下,以N-溴代酰亚胺(如NBS)对底物烯丙位和苄位进行溴化。[3]
| 沃尔-齐格勒溴化反应 | |
|---|---|
| 命名根据 | 阿尔弗雷德·沃尔 卡尔·齐格勒 |
| 反应类型 | 取代反應 |
| 标识 | |
| 有机化学网站对应网页 | wohl-ziegler-reaction |
| RSC序号 | RXNO:0000225 |
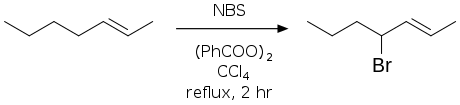
反应以NBS为试剂,在四氯化碳中进行时一般产率最高。 该反应综述有:[4][5]
通常条件是以四氯化碳为溶剂,加入计量的NBS、少量引发剂,一边搅拌一边加热反应液至沸腾。反应液猛烈沸腾是反应已引发的迹象;若反应液过热则需撤出热源。当比溶剂重的NBS全部反应,转变为丁二酰胺漂浮在反应液表面时,反应即已完成。因为四氯化碳具有强烈毒性,且可能消耗过氧化物,所以通常使用三氟甲苯作为替代溶剂。[6]
NCS(N-氯代丁二酰亚胺)通常不能实现对应的氯化反应,[7]但已经开发出更多的氯化专用试剂,[8]工业上也可以直接使用氯气反应。[9]
机理
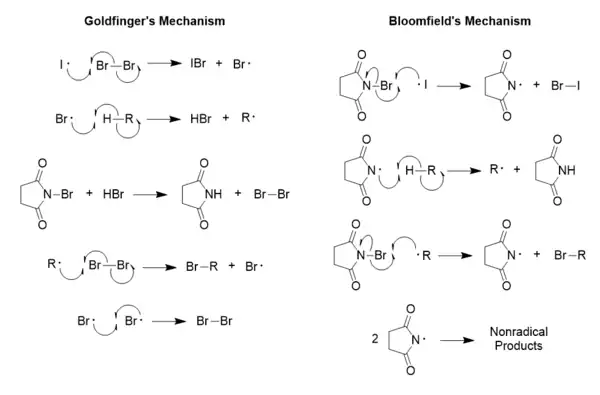
1953年保罗·戈德芬格提出了该反应的机理,该机理是脂肪烃、烯丙基、苄基与NBS发生反应的两条途径之一,[10] 另外一条途径由乔治·布卢姆菲尔德提出。实验证明对于该反应戈德芬格机理是正确的,布卢姆菲尔德机理虽然选择性是正确的,但过于简单。[10]
布卢姆菲尔德机理所阐述的NBS自由基生成过程比想象中难发生得多(但有证据表明,NBS氧化醇类的反应中布卢姆菲尔德机理仍然可以接受)。[10]戈德芬格机理中,NBS只是用来维持非常低的溴分子浓度,而不直接参与溴化反应,也不引发链反应。[11][12] 只有NBS中N-Br键的解离能比Br-Br键小时,布卢姆菲尔德机理才成立,而实际上N-Br键的解离能更大。[12][13]
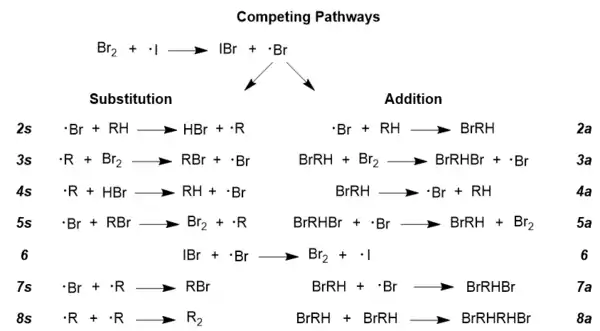
要进一步研究反应机理,有一点必须了解:在任何自由基反应中都有相互竞争的自由基途径,比如此处就有取代和加成两个途径。[14] 要获得所需的溴代产物,反应就必须以取代途径为主,而且可以通过操控反应条件来增加取代反应的比例。[13] 下图是这两条途径,为了完整起见,图中包含了一些副反应,如步骤6和步骤8。几乎所有的自由基反应都普遍是这几条途径,所以这里NBS并没有列出来,它的作用将会在下面讨论。
NBS在戈德芬格机理中的作用是促进溴分子的再生,[10] 还可以保证溴分子始终处于较低浓度,这是促进取代反应而非加成反应发生的关键。[13]下面给出的两个速率方程定量地表明了两个反应对溴分子浓度的高度敏感性:(r(a/s) 指加成反应与取代反应的速率之比)[13]
- 高浓度溴:r(a/s) = k2a/k2s(1 + k4a/k3a[Br2])
- 低浓度溴:r(a/s) = k2ak3a[Br2]/k3ak4a
可见,在低浓度溴的方程中,加成与取代的比例与溴浓度成正比,因此降低溴浓度可以抑制加成途径,从而促进溴代产物的形成。[13]
另见
- 自由基卤化
- 化学反应列表
参考资料
- Alfred Wohl. . 德国化学学报. 1919, 52: 51–63 [2020-02-15]. doi:10.1002/cber.19190520109. (原始内容存档于2020-02-15).
- 卡尔·齐格勒, G. Schenck, E. W. Krockow, A. Siebert, A. Wenz, H. Weber. . 利比希化学纪事. 1942, 551: 1–79. doi:10.1002/jlac.19425510102.
- (1963) "4-Bromo-2-heptene". Org. Synth.; Coll. Vol. 4: 108.
- C. Djerassi. . 化学评论. 1948, 43 (2): 271–317. PMID 18887958. doi:10.1021/cr60135a004.
- Horner, L; Winkelman, E. M. . 应用化学 (期刊). 1959, 71 (11): 349. doi:10.1002/ange.19590711102.
- Suarez, Diana; Laval, Gilles; Tu, Shang-Min; Jiang, Dong; Robinson, Claire L.; Scott, Richard; Golding, Bernard T. . Synthesis. June 2009, 2009 (11): 1807–1810. ISSN 1437-210X. doi:10.1055/s-0029-1216793 (英语).
- Djerassi, Carl. . Chemical Reviews. 1948-10-01, 43 (2): 271–317. ISSN 0009-2665. PMID 18887958. doi:10.1021/cr60135a004.
- Theilacker, Walter; Wessel, Heinz. . Justus Liebigs Annalen der Chemie. 1967, 703 (1): 34–36. ISSN 1099-0690. doi:10.1002/jlac.19677030105 (德语).
- Krähling, Ludger; Krey, Jürgen; Jakobson, Gerald; Grolig, Johann; Miksche, Leopold, , Ullmann's Encyclopedia of Industrial Chemistry (American Cancer Society), 2000, ISBN 9783527306732, doi:10.1002/14356007.a01_425 (英语)
- Incremona, J.H.; Martin, J.C. . J. Am. Chem. Soc. 1970, 92 (3): 627–634. doi:10.1021/ja00706a034.
- Bloomfield, G.F. . J. Am. Chem. Soc. 1944: 114–120. doi:10.1039/JR9440000114.
- Nonhebel, D.C.; Walton, J.C. . London: Cambridge University Press. 1974: 191–193. ISBN 978-0521201490.
- Adam, J.; Gosselain, P.A.; Goldfinger, P. . Nature. 1953, 4355: 704–705.
- Neuman, R.C. . Online: Robert C. Neuman, Jr. 1992.