溶解
溶解(英語:)又稱溶剂化(solvation)、溶劑合作用[1],是溶质分散于溶剂中而成为一个分子混合状态的溶液的过程[2]。溶剂化描述了溶剂与溶解分子的相互作用。离子化的分子和不带电的分子,都可与溶剂发生强烈的相互作用;此作用的强度和性质影响溶质的许多性质,包括溶解度、反应性和颜色,也影响溶剂的性质,如黏度和密度。
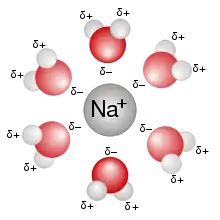
一个被水分子溶解的钠离子
当离子溶解时,它们会散布开来并被溶剂分子包裹。离子越大,能包裹它的溶剂分子就越多。有时溶解会产生放热、吸热的现象,例如氯化铵溶于水时会吸热使液体温度降低,而氢氧化钠溶于水时会放热使溶液温度升高。一般地,稳定、单一的溶液没有廷得耳效應。
部分物质溶解性表
表格摘自人民教育出版社高等中学《化学》教科书
| 阳离子\阴离子 | OH- | NO3- | Cl- | SO42- | CO32- |
|---|---|---|---|---|---|
| H+ | 不存在 | 可溶、挥发 | 可溶、挥发 | 可溶 | 可溶、挥发 |
| NH4+ | 可溶、挥发 | 可溶 | 可溶 | 可溶 | 可溶 |
| K+ | 可溶 | 可溶 | 可溶 | 可溶 | 可溶 |
| Na+ | 可溶 | 可溶 | 可溶 | 可溶 | 可溶 |
| Ba2+ | 可溶 | 可溶 | 可溶 | 不溶 | 不溶 |
| Ca2+ | 微溶 | 可溶 | 可溶 | 微溶 | 不溶 |
| Mg2+ | 不溶 | 可溶 | 可溶 | 可溶 | 微溶 |
| Al3+ | 不溶 | 可溶 | 可溶 | 可溶 | 不存在 |
| Mn2+ | 不溶 | 可溶 | 可溶 | 可溶 | 不溶 |
| Zn2+ | 不溶 | 可溶 | 可溶 | 可溶 | 不溶 |
| Fe2+ | 不溶 | 可溶 | 可溶 | 可溶 | 不溶 |
| Fe3+ | 不溶 | 可溶 | 可溶 | 可溶 | 不存在 |
| Cu2+ | 不溶 | 可溶 | 可溶 | 可溶 | 不存在 |
| Ag+ | 不存在 | 可溶 | 不溶 | 微溶 | 不溶 |
参考
- https://terms.naer.edu.tw/detail/b5414193273d17fdee6cd1481b8b3b99/?seq=1
- . [2023-07-23]. (原始内容存档于2023-07-23).
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.