电位滴定法
电位滴定法(Potentiometric titration)是一种利用溶液电极电位的突跃来指示终点的滴定方法。[1]:37与传统的氧化还原滴定不同之处是无须指示剂,而是在溶液中插入两根电极,分别称指示电极与参比电极,测量电位随滴定剂加入体积的变化来指示终点。指示电极与溶液组成半电池,测量滴定涉及电对的电极电势。参比电极则是一电位稳定的半电池,常用的有氯化银电极、飽和甘汞電極等。
整个电池的电动势的计算式为Ecell = Eind - Eref + Esol。其中, Esol是滴定中参与反应离子的电极电势,Ecell是滴定过程中测得的电势差。以加入体积对电势差作图,得滴定曲线,滴定终点为电势突跃最大处。
历史
电位滴定法于1893年首次由莱比锡奥斯特瓦尔德研究所的罗伯特·布伦德进行。选用氯化钾、溴化钾和碘化钾滴定硝酸亚汞。参比电极是汞/硝酸亚汞电极。电池的初始电位差为0,加入氯化钾后,会沉淀析出氯化亚汞,溶液中亚汞离子浓度降低,与参比电极间产生浓差电位。进一步加入氯化钾,电位差缓慢增加,直到发生突跃。他发现突跃点正是亚汞离子完全沉淀之时,意味着能通过测量电位差指示滴定终点。[2]
威廉·伯特在奥斯特瓦尔德研究所工作时设计了电位滴定的相关仪器。[3]他使用电位滴定来研究强酸、弱酸以及多元酸在滴定中的差异。他提出该法可应用于找不到合适化学指示剂时的酸碱滴定。[2]
终点判定
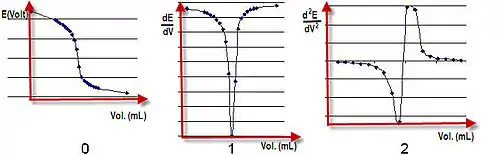
与传统的滴定分析根据终点时指示剂颜色变化不同,电位滴定法根据滴定剂加入体积与电势的E-V曲线来判断终点。通常有以下几种判据:[1]:38
- E-V曲线上的突跃;
- 一阶微商曲线(曲线)的极值处;
- 二阶微商曲线(曲线)等于零时的体积。
或者根据滴定数据计算二阶微商,找到符号相反对应的两个体积V_1和V_2,则终点体积可根据以下插值公式得到:
应用
电位滴定能用于各种种类的滴定,包括酸碱滴定、络合滴定、沉淀滴定和氧化还原滴定。应用自动电位滴定计,监测滴定过程中的pH或电位,实现在终点时自动停止。[1]:43
例如在工业生产中,利用电位滴定测量啤酒中苦味物质异葎草酮浓度。其方法是首先使用异辛烷或石油醚定量萃取,然后用乙酸镍或乙酸铅溶液滴定。异葎草酮能与这些金属离子形成络合物,电位差随之变化,并在滴定终点发生突跃。[4]
参考资料
- 方慧群; 于俊生、史坚. . 北京: 科学出版社. 2001. ISBN 7-03-009902-8.
- Szabadváry, Ferenc. History of Analytical Chemistry: International Series of Monographs in Analytical Chemistry. Elsevier, 2013.
- Burns, D. Thorburn, et al. Important Figures of Analytical Chemistry from Germany in Brief Biographies: From the Middle Ages to the Twentieth Century. Springer, 2014.
- Hudson, J. R., and A. H. Cooper. "CONDUCTOMETRIC ANALYSIS OF HOP BITTER SUBSTANCES." Journal of the Institute of Brewing 66.4 (1960): 298-301..