肿瘤基因组学
肿瘤基因组学(英語:)又称癌症基因组学(英語:)是基因组学中一门新兴的子学科,主要是通过高通量测序技术来将基因与癌症关联起来的学问。肿瘤是一种由 DNA 变异不断累积而导致细胞发生不受控激增并形成新生物的疾病。肿瘤基因组学的主要目标是通过鉴定新的原癌基因或者抑癌基因来为肿瘤诊断、肿瘤临床结果预测和肿瘤靶标治疗提供新的方法。肿瘤基因组学的应用导致了诸如伊马替尼、曲妥珠单抗和安维汀等的肿瘤靶标治疗的成功[1]。

除了理解和找出肿瘤产生和发展的遗传学机制外,肿瘤基因组学最主要的目的是为了开发肿瘤个性化治疗的方法。肿瘤的产生是由于 DNA 变异的累积。但这些变异是随机产生的,甚至在相同类型的肿瘤个体间变异的种类和组合都不相同。所以能够识别和定位病人个体的独特变异可能会提高肿瘤的治疗效果。
人类基因组计划的完成在很大程度上加速了肿瘤基因组学的发展,让研究人员可以更容易的定位引起肿瘤的基因。另外,测序技术的发展也让研究院可以获取基因测序数据,研究肿瘤基因组学的测序数据分析方法也逐步建立起来。随着大量的肿瘤基因组学研究工作的展开和随之而来的大量变异数据的积累,预计在十年后引起肿瘤的主要变异、重排和表达水平差异都会被较好的描述和记录下来。肿瘤研究不会仅仅关注基因组水平的变异,同时还会关注表观遗传水平上的甲基化和组蛋白修饰变化,转录组上的基因表达差异或者蛋白组上的肿瘤细胞的蛋白浓度和功能情况。总之,肿瘤基因组学专注在研究肿瘤细胞在基因组,表观组和转录组水平的变化。
历史
随着20世纪90年代很多组织DNA序列的测定,基因组学逐渐建立起来。到了21世纪,人类基因组计划在威康信托基金会桑格研究所 的完成为很多在基因组功能和疾病基因方面的研究铺平了大道。肿瘤便是是其中的主要研究对象之一。
为什么能够进行肿瘤基因组测序对肿瘤研究至关重要的原因有如下几点:
- 在肿瘤基因组中的变异是肿瘤疾病引起的直接原因,同时肿瘤的表型也由这些变异来决定。
- 由于能够获取肿瘤病人的肿瘤组织和正常组织,根据绝大多数变异都是体细胞变异的事实,我们便可以联合确认导致肿瘤的变异。
- 在肿瘤中,基因组上的变异并不是一成不变的,在一些肿瘤情况中会随着肿瘤阶段、转移以及抗药作用发生改变。[2]
在2008年第一个肿瘤基因组由Timothy J. Ley et. al测出。[2] 这次研究测序了一个典型急性髓性白血病患者的肿瘤基因组以及病人表皮的正常细胞基因组。研究人员通过对肿瘤和正常基因组测序数据的比较找到了10个基因包含了如下变异:
- 其中两个变异在之前就被认为对肿瘤发展有促进,分别是:
- FLT3受体酪氨酸激酶基因的内部串联重复,其结构性激活激酶发射信号,并与不良预后相关。
- NPM1基因(NPMc)第12个外显子上的四碱基插入
- 以上二者常见于白血病(约25~30%),且都被认为是有助于白血病的发展,而非直接导致白血病的发生。
- 剩余八个变异是新的变异,且都是单碱基突变:
- 四个变异发生在同一个家族,后者与肿瘤发生强相关(PTPRT, CDH24, PCLKC, and SLC15A1)
- 其余四个变异未见于已知的与癌症发生相关的基因,但在那些与促进肿瘤发展相关的代谢通路上有潜在功能(KNDC1, GPR124, EB12, GRINC1B)。
以上这些基因都位于促进肿瘤发生的通路中,但在本次研究之前,基于肿瘤基因的优先考虑,它们中的多数都不会被选作治疗的靶向基因。所以本次研究的结果也展示了用肿瘤全基因组测序技术来鉴定体细胞突变的重要性,以及对病人正常基因组的平行测序来确定哪些突变/变异是遗传的,哪些是获得的。这项技术在鉴定真正的体细胞突变方面十分重要。[3]
相关技术
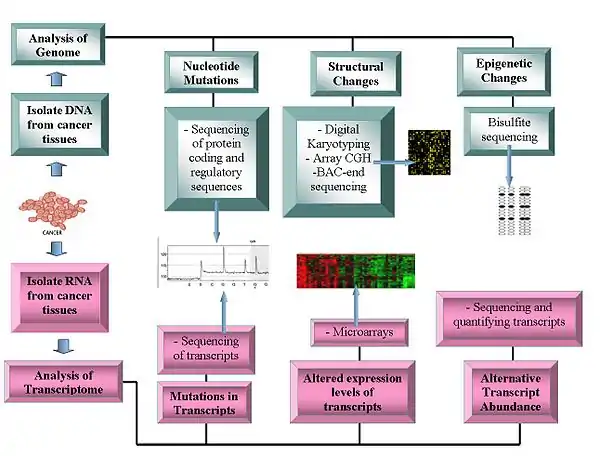
癌症细胞的基因组与转录组的研究以下面先端技术为基石。
癌症基因组
- 高通量 DNA 测序技术:透过焦磷酸测序实现的高通量 DNA 测序平台已在这几年内大大的改变基因组学的发展。这些系统产生的测序数据价格相对低廉,已成为众多肿瘤基因组研究者的必备工具。[1][4][5]
- 阵列比较基因组杂交:这种技术测量了不同基因组的 DNA 拷贝数差异。这种方法可以用来得到癌症基因组上相较于正常基因组的基因获取/缺失。阵列比较基因组杂交技术测量微阵列芯片上已知探针杂交的 DNA 样本的荧光强度,透过荧光强度的比值量化癌症基因组的拷贝数变异[6][7]。
- 代表性寡核苷酸微阵列分析:这也是一种利用微阵列侦测拷贝数变异的技术,利用限制酶剪切后的基因组片段扩增后的结果代表癌症基因组,这些片段与阵列上的人类基因组寡核苷酸杂交,分辨率大约是每 30 到 35 KB 一个数据[8]。
- 数位核型分析:又是另一种高分辨率、高通量量化样本里基因拷贝数的方法。将样本 DNA 利用限制酶剪切后的基因组片段,与 PET 相连、扩增之后再测序。将这些序列映射到参考基因组即可量化基因组 DNA 增强或是删除的区域[9][10]。
- 细菌人工染色体-end 测序(尾端序列 profiling):这是另一种在肿瘤基因组学使用的高分辨率找出染色体断点位置的方法。使用癌症基因组建 BAC 库之后将这些序列进行尾端测序。带有染色体异常的 BAC 库的尾端序列会有无法映射到参考基因组尾端序列的情形,在这种情况下癌症基因组上有染色体断点的情形、所在基因即可被量化[11]。
癌症转录组
- 微阵列:微阵列仍然为界定肿瘤细胞中转录大小最有力的工具。转录组在分类不同种类的癌症与预测癌症的预后上提供了多种方法,并使得根据癌症种类决定治疗方法的思路成为可能。透过高通量测序技术直接为肿瘤组织的转录组进行测序也可以帮助研究人员找出发生在编码区域的突变[12][13]。
另外,转率组各种可能的可变剪切结果的相对大小也成为肿瘤研究的重要组成:科学家已发现某些剪切形式与特定的癌症类型相关。在这种发现的影响下,得以量化可变剪切形式的新世代外显子阵列技术与其他转录组测序技术已成为肿瘤基因组学的重要部分[14]。
生物信息学与肿瘤基因的功能分析
在测序与表达数据量逐渐增大的现在,生物信息学的发展已成为关键。另外,在各种肿瘤基因已经被发现的现在,对于这些基因的功能描述与这些基因整体如何产生癌症表型的研究仍未完成。举例来说,检验肿瘤基因的转化能力即可确认这些肿瘤基因对于肿瘤形成有作用。另外,肿瘤细胞有各种 DNA 突变,找出哪些基因在肿瘤形成与发展的早期有关键作用也是件重要的研究工作。在这些基因中找到突变会是未来癌症诊断并找出治疗方法中最关键的步骤。
操纵子组
肿瘤基因组学中的操纵子组研究是将基因组、转录组、蛋白质组结合,以得到肿瘤发展的完整分子机制为目标的一种方向[15] 。操纵子组研究同时对肿瘤组织样本里的 DNA、RNA 与蛋白质进行分析,会是各种分析肿瘤细胞的技术不断积累、进步之后,往后癌症研究的最终目标。
比较肿瘤基因组学
比较肿瘤基因组学是肿瘤基因组学的一个分支,比较肿瘤基因组学通过跨物种的基因组比较来鉴别癌基因。这种研究包括对其他模式生物(如小鼠)的肿瘤基因组、转录组和蛋白组的研究,从而鉴别潜在的癌基因,然后将研究结果转化到研究人类肿瘤样本中,来鉴别这些基因的人类的同源基因在人类肿瘤发生扮演者重要的角色。[16]最近的研究发现小鼠模型中基因突变与人类肿瘤相似。肿瘤基因组学的这一支可以将对某些模式动物的研究成果应用到其他物种中。这些模型通过多种方法产生,包括逆转录病毒引发的基因突变和癌细胞的转移种植。比较肿瘤基因组学是癌基因鉴别的一个好方法。
联合致命性/条件遗传学
肿瘤基因组学研究的一个方向是通过利用肿瘤细胞的基因突变这一异常来制造有效的肿瘤的治疗方法,这以方向展示了良好的前景。是合成针对肿瘤基因突变位点的药物。常见的癌基因可能对所有细胞(不仅是肿瘤细胞)的生存都至关重要。所以,针对这些基因的药物可能产生强烈的副作用,比如肿瘤化疗药物可能直接引发其他严重疾病。为了制造更加安全的肿瘤靶向药物,科学家现在系统性地评估抑制人类基因组中每一个基因的影响——每次抑制一个基因与研究认为为癌基因的突变结合。[17][18] 这种研究通过利用仅存于肿瘤细胞的突变寻找肿瘤的靶向疗法。如果敲除那些对于正常细胞是无用或影响很小,而对携带了给定癌基因的肿瘤细胞是致命的基因,那么这些非必需基因在人类整体的抑制可以摧毁肿瘤细胞,同时最大程度的保护正常细胞。(这里的“合成药物”即描述了这种协同效应)在寻找肿瘤靶点和开发药物中这种方法已经初见成效。比如:PARP-1抑制剂可以靶向地针对BRCA1/BRCA2相关肿瘤[19][20]。在这个例子中,PARP-1的抑制和肿瘤相关的BRCA基因突变同时出现对这些肿瘤细胞是致命的。这项技术的临床Ⅰ期试验表明此方法有希望应用于BRCA1或BRCA2突变的患者。临床Ⅱ期实验现在正在进行中。
肿瘤研究的数据库
大量存有肿瘤基因组数据的数据库可供肿瘤研究者使用。肿瘤基因计划就是这样的一项为了发现肿瘤细胞内基因内的突变的计划。为了达成这一目标,他们为原发肿瘤和肿瘤细胞系的外显子和flanking splice junctions进行测序。这些研究数据展示,存储在COSMIC (页面存档备份,存于)。截至到2008年2月,肿瘤基因计划在1848个肿瘤标本中发现4746个基因和2985个突变。 美国肿瘤研究院下属的Cancer Genome Anatomy Project|肿瘤基因组图谱计划 (页面存档备份,存于)也存储了大量肿瘤基因组、转录组和蛋白组的研究数据。Progenetix (页面存档备份,存于)是另一个癌细胞参考数据库,其展示了肿瘤的细胞遗产学和细胞分子遗传学。Oncomine (页面存档备份,存于)有编辑整理过的肿瘤转录组数据。 肿瘤基因组学综合数据库(The Integrative Oncogenomics database IntOGen,IntOGen)整合了用组织分类的多维的人类肿瘤基因组学数据,其中组织名符合ICD-O命名规范。[21]。IntOGen database (页面存档备份,存于)使不同变异类型(如基因表达,CNV)的数据挖掘称为可能。 国际肿瘤基因组联盟(International Cancer Genome Consortium )是目前收集人类肿瘤基因组数据的最大的项目。这些数据可以通过ICGC website (页面存档备份,存于)访问。BioExpress® Oncology Suite有原发性肿瘤、转移性肿瘤、良性肿瘤和正常组织(包括癌旁组织)的基因表达数据。这个数据库包含了非常有价值的血液细胞恶性肿瘤样本。 针对模式生物的数据库一样存在,比如Retrovirus Tagged Cancer Gene Database (RTCGD)收录了大鼠肿瘤中逆转录病毒和转座子插入引发的基因突变。
肿瘤基因组学的新进展
整个基因家族的突变研究已经成为肿瘤基因组学的一个强大的工具,这带来了很多的进展。可以通过相似的序列和蛋白结构域来判定基因家族,同一个基因家族的基因拥有相似的功能,经过系统性地对肿瘤基因组中的这些基因测序,可以发现与肿瘤发生相关的信号通路。已经研究过的这种基因家族是蛋白激酶家族(其作用是给蛋白质添加磷酸基团)和磷酸酶基因家族(其作用是移除蛋白质的磷酸基团)。[22]这些基因家族被首先研究是因为其参与了细胞生长和死亡的信号传导。特别的,超过50%的结直肠癌中可发现超过一种磷酸激酶或磷酸酶突变。结直肠癌、乳腺癌、胃癌、肺癌和其他多种癌症的基因突变常见于PIK3CA(Phosphatidylinositold 3-kinases)基因。[23][24]多种开发中的药物就是抑制PIK3CA。另一个例子是2004年发现的BRFA基因,这是发现与黑色素瘤相关的第一个基因。[25]BRAF编码了丝苏氨酸激酶(其参与了RAS-RAF-MAPK信号通路),他们发现BRAF的突变将导致组合磷酸化和活性变化,这在59%的黑色素瘤都可发现。BRAF发现之前,黑色素瘤的发生发展的遗传学原理,所以,患者的预后很差。之后CGP开始研究黑色素瘤的相关基因,最后,他们发现BRAF,现在BRAF是肿瘤治疗的新靶点,已有相关临床研究数据。[26]
线粒体DNA突变与肿瘤的关系
最近研究发现,线粒体DNA突变和肿瘤的发生之间存在着一定联系。以下是四种已被鉴定的线粒体DNA突变类型:[27]
1. 点突变
在癌细胞线粒体DNA的编码区及非编码区都已被观察到点突变的存在。在膀胱癌、头颈癌和肺癌患者中,编码区的点突变表现出了同质性(与其他患者相似)。这预示着,当一个正常细胞转化为癌细胞时(例如经历致瘤性转化),其线粒体是向着相同方向变化的。另一方面,非编码区的点突变也表现出了一致性。癌细胞线粒体的DNA控制区的突变可能也是某些肿瘤中的重要特征。[27]
2. 缺失
由于突变区域较小( < 1kb ),缺失突变被检测到的频率并不高。在多种癌症中发生的某些特定的线粒体DNA突变 ( 如线粒体复合物1的亚基基因ND1上发生的264-bp缺失及66-bp 缺失 ) 预示着小型的线粒体DNA缺失可能发生在肿瘤发生的早期。这也预示着,随着肿瘤发生的进行,包含这些缺失突变的线粒体的数量会逐渐升高。然而这也是存在例外情况的。经研究发现,一种相对较大的碱基序列缺失发生在多数癌症中 ( 被称为"常见缺失" ),但一般来说正常细胞中的线粒体DNA大规模缺失是要比肿瘤细胞更多的。我们认为肿瘤细胞中可能存在一种自适应过程,它会把那些包含大规模缺失的线粒体给消除掉 (“常见缺失”的长度大于4kb)。[27]
3. 插入
经研究发现,两种小型的线粒体DNA插入突变( 约为~260及~520bp )存在于 乳腺癌、胃癌、肝细胞癌(HCC)和结肠癌中,但该突变在正常细胞中也被发现。 因而这些插入突变和癌症间的关系还有待确认。[28]
4. 线粒体DNA 定量改变( 拷贝数突变 )
通过实时PCR法检测,多种癌症细胞的线粒体DNA比正常细胞来说存在更多的线粒体DNA拷贝数变异。拷贝数的增加被认为是由氧化应激引起的,而拷贝数的减少的原因被认为有如下几种:重链复制起始位点的体细胞点突变,线粒体DNA控制区中D310多聚C-stretch序列的体细胞点突变,p53( 抑癌基因 )调控通路的突变,以及POLG(线粒体DNA聚合酶)突变引起的酶活性低下。尽管线粒体DNA拷贝数存在增加或减少,但其在肿瘤细胞间确实是维持一致的。跟正常细胞相比,肿瘤细胞线粒体DNA拷贝数的一致性表明在肿瘤细胞中,为了控制线粒体DNA的数量存在更为复杂的系统,而不是简单地随着异常细胞的增值就发生了改变。线粒体DNA含量被认为在某些特殊的人类肿瘤类型或位点上有着某种程度的特异性。[27]
| 癌症类型 | 点突变位置 | 核苷酸缺失位点 | 线粒体DNA拷贝数增加 # | 线粒体DNA拷贝数减少 # | 参考文献 | |||
|---|---|---|---|---|---|---|---|---|
| 线粒体DNA控制区 | mRNAs | tRNAs | rRNAs | |||||
| 膀胱癌 | X | X | X | 15,642-15,662 | [29] | |||
| 乳腺癌 | X | X | X | X | 8470-13,447 and 8482-13459 | X | [30][31][32][33] | |
| 头颈癌 | X | X | X | X | 8470-13,447 and 8482-13459 | X | [30][34][35] | |
| 口腔癌 | X | X | 8470-13,447 and 8482-13459 | [36] | ||||
| 肝细胞癌(HCC) | X | X | X | X | 306-556 and 3894-3960 | X | [37][38] | |
| 食管癌 | X | X | X | 8470-13,447 and 8482-13459 | X | [39] | ||
| 胃癌 | X | X | X | 298-348 | X | [40][41][42] | ||
| 前列腺癌 | X | X | 8470-13,447 and 8482-13459 | X | [43][44] | |||
关于表格: 多种癌症中的线粒体DNA突变。 该表格仅包含部分癌症类型。以上研究中有一个是着眼于不同癌症中的点突变位置,包含了867个癌症患者、23种癌症类型。 57.7% (500/867)的癌症含有体细胞点突变,而这些1172个突变中有37.8% (443/1127) 位于线粒体DNA控制区,13.1% (154/1172)位于tRNA或rRNA基因,49.1% (575/1127) 位于负责产生与线粒体呼吸作用有关的复合物的mRNA基因上。
在诊断领域的潜在应用
目前已有线粒体DNA靶向的抗肿瘤药物并在杀死肿瘤细胞方面有其效果,而以线粒体突变为生物标记来提供治疗手段的研究也有一定成果。相比核DNA突变,线粒体DNA突变更容易作为靶标,因为线粒体基因组较小因而更容易找出特异性突变。另外也有人认为,血液样本中可检测到的线粒体DNA数量变异也可用作标记物,可用来预测个体的癌症易感程度以及判定恶性肿瘤发生阶段。除了以上这些特性外,线粒体DNA的不受细胞周期控制,在产生ATP及维持线粒体稳态方面都非常重要,的这些特性使得靶向线粒体DNA成为一个可行的治疗策略。[27]
肿瘤标志物
随着该领域的发展,科学家正在发掘可用于肿瘤发生阶段判定、治疗、预后的潜在标志物。目前已有许多生物标志物可用于上述目的,比如单核苷酸多态性(SNPs),染色体畸变,DNA拷贝数变异,微卫星不稳定性,启动子区域差异甲基化,甚至是高/低蛋白表达水平。这些特性与各种癌症的关系的确定将有可能帮助我们通过开发靶向特异标志物的药物来提供更多有效的个性化治疗选择。如果想了解一些癌症及其各自生物标志物的信息的话,请点击肿瘤标志物页面。[45]
参考资料
- Strausberg R.L.; Simpson, Andrew J.G.; Old, Lloyd J.; Riggins, Gregory J.; et al. . Nature. 2004, 429 (6990): 469–474. Bibcode:2004Natur.429..469S. PMID 15164073. doi:10.1038/nature02627.
- Strausberg, R L; Simpson, A J G. . British Journal of Cancer. 22 December 2009, 102 (2): 243–248. PMC 2816661
 . PMID 20029419. doi:10.1038/sj.bjc.6605497.
. PMID 20029419. doi:10.1038/sj.bjc.6605497. - Ley, Timothy J.; Mardis, Elaine R.; Ding, Li; Fulton, Bob; McLellan, Michael D.; Chen, Ken; Dooling, David; Dunford-Shore, Brian H.; McGrath, Sean; Hickenbotham, Matthew; Cook, Lisa; Abbott, Rachel; Larson, David E.; Koboldt, Dan C.; Pohl, Craig; Smith, Scott; Hawkins, Amy; Abbott, Scott; Locke, Devin; Hillier, LaDeana W.; Miner, Tracie; Fulton, Lucinda; Magrini, Vincent; Wylie, Todd; Glasscock, Jarret; Conyers, Joshua; Sander, Nathan; Shi, Xiaoqi; Osborne, John R.; Minx, Patrick; Gordon, David; Chinwalla, Asif; Zhao, Yu; Ries, Rhonda E.; Payton, Jacqueline E.; Westervelt, Peter; Tomasson, Michael H.; Watson, Mark; Baty, Jack; Ivanovich, Jennifer; Heath, Sharon; Shannon, William D.; Nagarajan, Rakesh; Walter, Matthew J.; Link, Daniel C.; Graubert, Timothy A.; DiPersio, John F.; Wilson, Richard K. . Nature. 2008, 456 (7218): 66–72. Bibcode:2008Natur.456...66L. PMC 2603574
 . PMID 18987736. doi:10.1038/nature07485.
. PMID 18987736. doi:10.1038/nature07485. - Bardelli A., Velculescu V.E. . Current Opinion in Genetics & Development. 2005, 15 (1): 5–12. doi:10.1016/j.gde.2004.12.009.
- Benvenuti S., Arena S., Bardelli A. . Febs Letters. 2005, 579 (8): 1884–1890. PMID 15763568. doi:10.1016/j.febslet.2005.02.015.
- Shih I.M., Wang T.L. . Current Opinion in Oncology. 2005, 17 (1): 33–38. PMID 15608510. doi:10.1097/01.cco.0000147382.97085.e4.
- Greshock J.; et al. . Genome Research. 2004, 14 (1): 179–187. PMC 314295
 . PMID 14672980. doi:10.1101/gr.1847304.
. PMID 14672980. doi:10.1101/gr.1847304. - Lucito R.; et al. . Genome Research. 2003, 13 (10): 2291–2305. PMC 403708
 . PMID 12975311. doi:10.1101/gr.1349003.
. PMID 12975311. doi:10.1101/gr.1349003. - Hu M., Yao J., Polyak K. . Nature Protocols. 2006, 1 (3): 1621–1636. PMID 17406428. doi:10.1038/nprot.2006.278.
- Korner H.; Epanchintsev, Alexey; Berking, Carola; Schuler-Thurner, Beatrice; Speicher, Michael R.; Menssen, Antje; Hermeking, Heiko; et al. . Cell Cycle. 2007, 6 (2): 189–198. PMID 17314512. doi:10.4161/cc.6.2.3733.
- Volik S.; Zhao, S.; Chin, K.; Brebner, J. H.; Herndon, D. R.; Tao, Q.; Kowbel, D.; Huang, G.; et al. . Proceedings of the National Academy of Sciences of the United States of America. 2003, 100 (13): 7696–7701. Bibcode:2003PNAS..100.7696V. PMC 164650
 . PMID 12788976. doi:10.1073/pnas.1232418100.
. PMID 12788976. doi:10.1073/pnas.1232418100. - Van , de Vijver M.J.; et al. . New England Journal of Medicine. 2002, 347 (25): 1999–2009. PMID 12490681. doi:10.1056/NEJMoa021967.
- Van , Veer L.J.; et al. . Breast Cancer Research. 2002, 5 (1): 57–58. PMC 154139
 . PMID 12559048. doi:10.1186/bcr562.
. PMID 12559048. doi:10.1186/bcr562. - Xu Q., Lee C. . Nucleic Acids Research. 2003, 31 (19): 5635–5643. PMC 206480
 . PMID 14500827. doi:10.1093/nar/gkg786.
. PMID 14500827. doi:10.1093/nar/gkg786. - Hanash S.M. . Clinical Chemistry and Laboratory Medicine. 2000, 38 (9): 805–813. doi:10.1515/CCLM.2000.116.
- Peeper D., Berns A. . Cell. 2006, 125 (7): 1230–1233. PMID 16814709. doi:10.1016/j.cell.2006.06.018.
- Kaelin W.G. . Nature Reviews Cancer. 2005, 5 (9): 689–698. PMID 16110319. doi:10.1038/nrc1691.
- O'Connor M.J., Martin N.M.B., Smith G.C.M. . Oncogene. 2007, 26 (56): 7816–7824. PMID 18066095. doi:10.1038/sj.onc.1210879.
- Farmer H., McCabe N., Lord C.J.; McCabe; Lord; Tutt; Johnson; Richardson; Santarosa; Dillon; Hickson; Knights; Martin; Jackson; Smith; Ashworth; et al. . Nature. 2005, 434 (7035): 917–921. Bibcode:2005Natur.434..917F. PMID 15829967. doi:10.1038/nature03445.
- Bryant H.E.; Schultz, Niklas; Thomas, Huw D.; Parker, Kayan M.; Flower, Dan; Lopez, Elena; Kyle, Suzanne; Meuth, Mark; Curtin, Nicola J.; Helleday, Thomas; et al. . Nature. 2005, 434 (7035): 913–917. Bibcode:2005Natur.434..913B. PMID 15829966. doi:10.1038/nature03443.
- Gundem G.; Perez-Llamas, Christian; Jene-Sanz, Alba; Kedzierska, Anna; Islam, Abul; Deu-Pons, Jordi; Furney, Simon J; Lopez-Bigas, Nuria; et al. . Nature Methods. 2010, 300 (5621): 92–93. doi:10.1038/nmeth0210-92.
- Blume-Jensen P., Hunter T. . Nature. 2001, 411 (6835): 355–365. PMID 11357143. doi:10.1038/35077225.
- Bardelli A.; et al. . Science. 2003, 300 (5621): 949–949. PMID 12738854. doi:10.1126/science.1082596.
- Samuels Y.; et al. . Science. 2004, 304 (5670): 554–554. PMID 15016963. doi:10.1126/science.1096502.
- Davies H.; Bignell, Graham R.; Cox, Charles; Stephens, Philip; Edkins, Sarah; Clegg, Sheila; Teague, Jon; Woffendin, Hayley; Garnett, Mathew J.; Bottomley, William; Davis, Neil; Dicks, Ed; Ewing, Rebecca; Floyd, Yvonne; Gray, Kristian; Hall, Sarah; Hawes, Rachel; Hughes, Jaime; Kosmidou, Vivian; Menzies, Andrew; Mould, Catherine; Parker, Adrian; Stevens, Claire; Watt, Stephen; Hooper, Steven; Wilson, Rebecca; Jayatilake, Hiran; Gusterson, Barry A.; Cooper, Colin; et al. . Nature. 2002, 417 (6892): 949–954. PMID 12068308. doi:10.1038/nature00766.
- Danson S., Lorigan P. . Drugs. 2005, 65 (6): 733–743. PMID 15819587. doi:10.2165/00003495-200565060-00002.
- Yu, Man. . Advances in Clinical Chemistry. Advances in Clinical Chemistry. 2012, 57: 99–138. ISBN 9780123943842. PMID 22870588. doi:10.1016/B978-0-12-394384-2.00004-8.
- Hung, W.Y.; J.C. Lin; L.M. Lee; et al. . Mutagenesis. 2008, 23 (2): 137–142. PMID 18252697. doi:10.1093/mutage/gen002.
- Fliss, M. S.; Usadel, H.; Caballero, O. L.; et al. . Science. 2000, 287 (5460): 2017–2019. Bibcode:2000Sci...287.2017F. PMID 10720328. doi:10.1126/science.287.5460.2017.
- Dani, M.A.; S.U. Dani; S.P. Lima; et al. . Genet. Mol. Res. 2004, 3 (3): 395–409. PMID 15614730.
- Ye, C.; X.O. Shu; W. Wen; et al. . Breast Cancer Res. Treat. 2008, 108 (3): 427–434. PMID 17541740. doi:10.1007/s10549-007-9613-9.
- Tseng, L.M.; P.H. Yin; C.W. Chi; et al. . Genes Chromosomes Cancer. 2006, 45 (7): 629–638. PMID 16568452. doi:10.1002/gcc.20326.
- Zhu, W.; W. Qin; P. Bradley; A. Wessel; C.L. Puckett; E.R. Sauter. . Carcinogenesis. 2005, 26 (1): 145–152. PMID 15375011. doi:10.1093/carcin/bgh282.
- Zhou, S.; Kachhap, S.; Sun, W.; et al. . Proc. Natl. Acad. Sci. USA. 2007, 104 (18): 7540–7545. Bibcode:2007PNAS..104.7540Z. PMC 1863503
 . PMID 17456604. doi:10.1073/pnas.0610818104.
. PMID 17456604. doi:10.1073/pnas.0610818104. - Poetsch, M.; A. Petersmann; E. Lignitz; B. Kleist. . Diagn. Mol. Pathol. 2004, 13 (1): 26–32. PMID 15163006. doi:10.1097/00019606-200403000-00005.
- Tan, D.J.; J. Chang; W.L. Chen; et al. . Ann. N. Y. Acad. Sci. 2004, 1011: 310–316. Bibcode:2004NYASA1011..310T. PMID 15126307. doi:10.1196/annals.1293.030.
- Lee, H.C.; S.H. Li; J.C. Lin; C.C. Wu; D.C. Yeh; Y.H. Wei. . Mutation Research. 2004, 547 (1–2): 71–78. PMID 15013701. doi:10.1016/j.mrfmmm.2003.12.011.
- Yin, P.H.; C.C. Wu; J.C. Lin; C.W. Chi; Y.H. Wei; H.C. Lee. . Mitochondrion. 2010, 10 (2): 174–182. PMID 20006738. doi:10.1016/j.mito.2009.12.147.
- Tan, D.J.; J. Chang; L.L. Liu; et al. . BMC Cancer. 2006, 6: 93. PMC 1459869
 . PMID 16620376. doi:10.1186/1471-2407-6-93.
. PMID 16620376. doi:10.1186/1471-2407-6-93. - Kassauei, K.; N. Habbe; M.E. Mullendore; C.A. Karikari; A. Maitra; G. Feldmann. . Int. J. Gastrointest. Cancer. 2006, 37 (2–3): 57–64. PMID 17827523. doi:10.1007/s12029-007-0008-2.
- Hung, W.Y.; C.W. Wu; P.H. Yin; et al. . Biochim. Biophys. Acta. 2010, 1800 (3): 264–270. ISBN 978-953-307-086-5. PMID 19527772. doi:10.5772/8630.
- Wu, C.W.; P.H. Yin; W.Y. Hung; et al. . Genes Chromosomes Cancer. 2005, 44 (1): 19–28. PMID 15892105. doi:10.1002/gcc.20213.
- Yu, J.J.; T. Yan. . Aging Male. 2010, 13 (3): 159–165. PMID 20136572. doi:10.3109/13685530903536668.
- Gomez-Zaera, M.; J. Abril; L. Gonzalez; et al. . Mutation Research. 2006, 595 (1–2): 42–51. PMID 16472830. doi:10.1016/j.mrfmmm.2005.10.012.
- Ludwig, Joseph A.; Weinstein, John N. . Nature Reviews Cancer. 20 October 2005, 5 (11): 845–856. PMID 16239904. doi:10.1038/nrc1739.
外部链接
- Cancer Genome Project: an oncogenomic reference database from the Wellcome Trust Sanger Institute
- Cancer Genome Anatomy Project (页面存档备份,存于): an oncogenomic reference database from the National Cancer Institute
- Progenetix (页面存档备份,存于): an oncogenomic reference database, presenting cytogenetic and molecular-cytogenetic tumor data
- OncoGenomics Explorer (页面存档备份,存于)
- Oncomine (页面存档备份,存于)
- Retrovirus Tagged Cancer Gene Database (RTCGD)
- IntOGen (页面存档备份,存于) Integration and data mining of multidimensional oncogenomic data