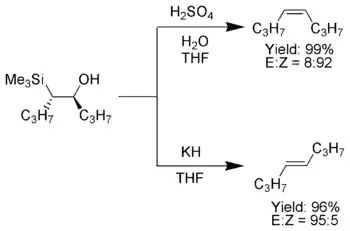
皮特森烯烃合成反应
皮特森烯烃合成(Peterson反应)是α-硅基碳负离子(如格氏试剂)与醛酮加成生成β-羟基有机硅烷,而后发生消除生成烯烃的反应。[1] 反应综述:[2][3][4][5]。
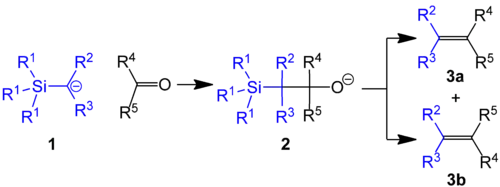
Peterson烯烃合成
立体专一性是此反应的一个显著特征。同一条件下,用β-羟基硅烷的两个非对映体分别发生消除,可以分别得到顺式和反式的烯烃。此外,同一个β-羟基硅烷在酸和碱介质中分别发生消除,也分别生成构型相反的烯烃。利用此性质可以控制产物烯烃的构型。
反应中不发生重排,具有很强的区域选择性,可用于合成末端烯烃或环外烯烃。但酸性和碱性的条件会使一些官能团受到破坏,比如双键在酸作介质时会发生重排,使产率降低,从而限制了该反应的应用。对此有很多改进办法。Chan等人的方法是用乙酰氯或氯化亚砜与羟基硅烷中间体反应,生成β-硅基酯,再使其在25°C发生分解,制取烯烃;[6] Corey等人是用α-硅基亚胺与醛酮反应,使中间体亚胺离子原位水解,一步制得烯烃。[7][8] Corey的方法也称为Corey-Peterson反应。
反应机理
碱性介质
羟基硅烷在碱作用下生成烷氧基负离子,进攻硅原子,形成四元环的中间体(推测),然后发生顺式消除生成烯烃。
醇盐作碱时,醇钾的反应速率最快,醇钠其次,醇镁最慢。这是因为氧原子的电子密度依次降低,亲核性逐渐减弱的缘故。
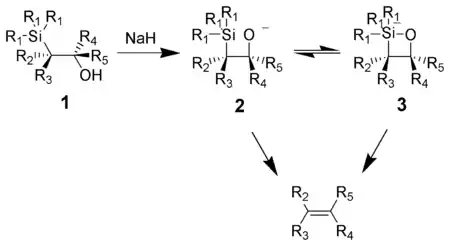
碱催化的消除机理
酸性介质
酸作用下,羟基质子化,然后水作亲核试剂,进攻硅原子,发生E2消除生成烯烃。过渡态中硅基与质子化的羟基呈反叠构象。
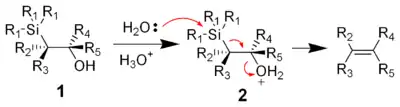
酸催化消除机理
参见
- Horner-Wadsworth-Emmons反应
- Tebbe烯烃合成
- Wittig反应
- 化学反应列表
参考资料
- D. J. Peterson. . J. Org. Chem. 1968, 33 (2): 780–784. doi:10.1021/jo01266a061.
- Birkofer, L.; Stiehl, O. Top. Curr. Chem. 1980, 88, 58.(综述)
- Ager, D. J. Synthesis 1984, 384-398.(综述)
- Ager, D. J. Org. React. 1990, 38, 1-223.(综述)
- T. H. Chan. . Acc. Chem. Res. 1977, 10 (12): 442–448. doi:10.1021/ar50120a003.
- T. H. Chan and E. Chang. . J. Org. Chem. 1974, 39 (22): 3264–3268. doi:10.1021/jo00936a020.
- X. Zeng, F. Zeng and E. Negishi. . Org. Lett. 2004, 6 (19): 3245–3248. doi:10.1021/ol048905v.
- E. J. Corey, D. Enders and M. G. Bock. . Tetrahedron Letters. 1976, 17 (1): 7–10. doi:10.1016/S0040-4039(00)71308-6.
- Barrett, A. G. M.; Flygare, J. A.; Hill, J. M.; Wallace, E. M. (1998). "Stereoselective Alkene Synthesis via 1-Chloro-1-[(dimethyl)phenylsilyl]alkanes and α-(Dimethyl)phenylsilyl Ketones: 6-Methyl-6-dodecene". Org. Synth.; Coll. Vol. 9: 580.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.