碳硼烷
碳硼烷是由硼和碳形成的原子簇化合物。如同硼烷一般,碳硼烷的分子結構也是多面體,並依據構造同樣分類為closo-(闭合式)、nido-(缺少一個頂點)、arachno-(缺少兩個頂點)、hypho-(缺少三個頂點)等等。

代表化合物

碳硼烷的一個特殊例子,為極端穩定的正二十面體闭合式碳硼烷。[1] 而其中重要的例子為電中性的C2B10H12,即鄰-碳硼烷(o-carborane),其在廣泛的應用領域如耐熱聚合物與醫學應用上均有所研究。由於此化合物符合休克爾規則,具有高度的芳香性,而且對熱相當穩定。鄰-碳硼烷在420°C轉變為間-碳硼烷,而苯需要加熱至1000°C以上才能發生結構重組。如同芳香烴一般,碳硼烷亦可發生親電芳香取代反應。
另一個重要的碳硼烷為帶負電的CHB11H12−陰離子,被用來製備固態的超強酸。
二碳代十二硼烷
被研究最多的碳硼烷是C2B10H12(熔點320°C)。此化合物通常由乙炔與癸硼烷合成。此外,也可以丁炔二醇二乙酸酯作原料,使產生的C2B10H10(O2CCH3)2分解生成C2B10H12。[2]
歷史
1,2-闭合式-二碳代十二硼烷(即鄰-碳硼烷,通常直接稱為碳硼烷),是同時被Olin Corporation的團隊以及美國空軍旗下Thiokol化工廠的Reaction Motors Division所發現的,並發表於1963年。[3][4][5][6][7][8][9][10][11] 同時蘇聯的一個團隊也發表了類似的成果。在此之前,癸硼烷衍生物被認為對熱不穩定,而且會與水和空氣反應,但這些團隊證實了1,2-闭合式-二碳代十二硼烷空前的穩定性,並發表了一般性的合成方法,不破壞碳硼烷核心下取代基的轉化,以及鄰位至間位的異構化反應。
二碳代十一硼烷阴离子
化學家對二碳代十一硼烷根陰離子[B9C2H11]2−做了許多研究。此陰離子與許多金屬離子形成夹心配合物,而且許多此類化合物當中,金屬離子呈現不尋常的氧化態。此離子呈巢型簇结构,可由母化合物二碳代十二硼烷分解產生:[12]
- B10C2H12 + 3 CH3OH + KOH → KB9C2H12 + B(OCH3)3 + H2O + H2
碳硼炔
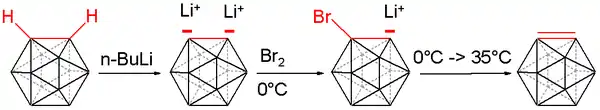
碳硼炔又稱1,2-去氫-鄰-碳硼烷(1,2-dehydro-o-carborane),是鄰-碳硼烷的一種不穩定衍生物,其化學式為B10C2H10。其與碳硼烷的差別,在於兩個相鄰碳原子上不具有氫。此化合物與苯炔相似並具有等瓣结构。[13][14][15] 第一個碳硼炔化合物於1990年由碳硼烷製備而成。碳上的氫離子使用四氫呋喃中的正丁基鋰移除,而產生的雙陰離子鋰鹽再於0°C下與溴反應,生成溴化單陰離子。
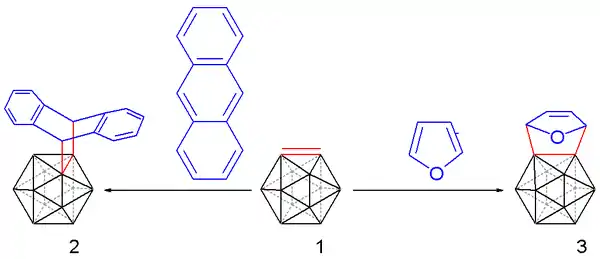
將反應混合物加熱至35°C釋放出碳硼炔,並使用合適的二烯以狄爾斯-阿爾德反應捕捉:
亦可与呋喃和蒽(產生類似三螺烯的化合物)反应,收率為10至25%。
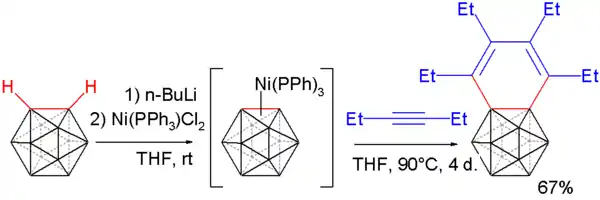
碳硼炔亦可使用上述反應的修改方式與炔烴反應,產生苯並碳硼烷。[16][17] 首先使用正丁基鋰移除碳硼烷上的質子,並與二氯-雙(三苯膦)鎳反應產生碳硼炔的鎳錯合物。此化合物再與3-己炔反應,經由炔烴三聚反應產生苯並碳硼烷。
參考資料及注释
- Eluvathingal D. Jemmis. . J. Am. Chem. Soc. 1982, 104: 7017–7020. doi:10.1021/ja00389a021.
- Kutal, C. R.; Owen, D. A.; Todd, L. J. . Inorganic Syntheses. 1968, 11: 19–23. doi:10.1002/9780470132425.ch5.
- T. L. Heying, J. W. Ager, S. L. Clark, D. J. Mangold, H. L. Goldstein, M. Hillman, R. J. Polak, and J. W. Szymanski. . Inorganic Chemistry. 1963, 2: 1089 – 1092. doi:10.1021/ic50010a002.
- H. Schroeder, T. L. Heying, J. R. Reiner. . Inorganic Chemistry. 1963, 2: 1092 – 1096. doi:10.1021/ic50010a003.
- T. L. Heying, J. W. Ager, S. L. Clark, R. P. Alexander, S. Papetti, J. A. Reid, S. I. Trotz. . Inorganic Chemistry. 1963, 2: 1097 – 1105. doi:10.1021/ic50010a004.
- S. Papetti, T. L. Heying. . Inorg. Chem. 1963, 2: 1105–1107. doi:10.1021/ic50010a005.
- M. M. Fein, J. Bobinski, N. Mayes, N. Schwartz, M. S. Cohen. . Inorg. Chem.]] 1963, 2: 1111 – 1115. doi:10.1021/ic50010a007.
- M. M. Fein, D. Grafstein, J. E. Paustian, J. Bobinski, B. M. Lichstein, N. Mayes, N. N. Schwartz, M. S. Cohen. . Inorg. Chem. 1963, 2: 1115 – 1119. doi:10.1021/ic50010a008.
- D. Grafstein, J. Bobinski, J. Dvorak, H. Smith, N. Schwartz, M. S. Cohen, M. M. Fein. . Inorg. Chem. 1963, 2: 1120 – 1125. doi:10.1021/ic50010a009.
- D. Grafstein, J. Bobinski, J. Dvorak, J. E. Paustian, H. F. Smith, S. Karlan, C. Vogel, M. M. Fein. . Inorg. Chem. 1963, 2: 1125 – 1128. doi:10.1021/ic50010a010..
- D. Grafstein, J. Dvorak. . Inorg. Chem. 1963, 2: 1128 – 1133. doi:10.1021/ic50010a011.
- Plešek, J.; Heřmánek, S.; Štíbr, B. Inorganic Syntheses, 1983, volume 22, pages 231-124.
- Henry L. Gingrich, Tirthankar Ghosh, Qiurong Huang, and Maitland Jones. . J. Am. Chem. Soc. 1990, 112 (10): 4082 – 4083. doi:10.1021/ja00166a080.
- E. D. Jemmis and B. Kiran. . J. Am. Chem. Soc. 1997, 119 (19): 4076–4077. doi:10.1021/ja964385q.
- B. Kiran, A. Anoop, E. D. Jemmis. . J. Am. Chem. Soc. 2002, 124: 4402–4407. doi:10.1021/ja016843n.
- Liang Deng, Hoi-Shan Chan, and Zuowei Xie. . J. Am. Chem. Soc. 2006, 128 (24): 7728 – 7729. doi:10.1021/ja061605j.
- Eluvathingal D Jemmis and Anakuthil Anoop. (PDF). MHPCC Application Briefs. 2004: 51. (原始内容 (PDF)存档于2006-07-13).
- 注意在圖片中,酸性氫並不是鍵結在碳硼烷分子的氫,而是平衡離子
- Juhasz, M.; Hoffmann, S.; Stoyanov, E.; Kim, K.-C.; Reed, C. A. (2004). Angew. Chem., Int. Ed. 43: 5352-5355. DOI: 10.1002/anie.200460005.
- Mark Juhasz, Stephan Hoffmann, Evgenii Stoyanov, Kee-Chan Kim, Christopher A. Reed. . Angewandte Chemie International Edition (Communication). 2004, 43: 5352 – 5355. doi:10.1002/anie.200460005.
- Christopher A. Reed. (PDF). Chem. Commun. 2005, 2005: 1669–1677 [2008-05-29]. doi:10.1039/b415425h. (原始内容 (Full article (reprint))存档于2020-05-11).