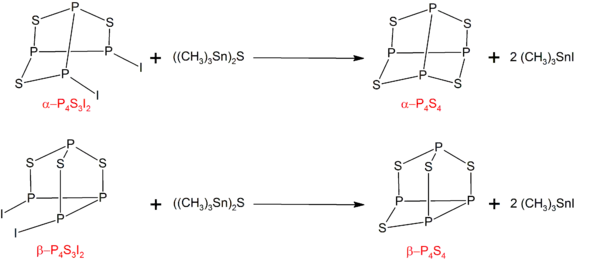磷的硫化物
磷的硫化物是一类无机化合物,只由磷和硫组成,通式为 P4Sx(x ≤ 10)。其中两种磷的硫化物具有商业意义:十硫化四磷 (P4S10)的产量达到千吨规模,用于生产有机硫化合物;而三硫化四磷 (P4S3)可用于制造火柴。
除了 P4S3 和P4S10以外,还存在多种磷的硫化物。其中六种有异构体:P4S4、P4S5、P4S6、P4S7、P4S8和 P4S9。它们的异构体以希腊字母前缀区别。这些前缀是以发现顺序排列的,而不是结构。[1] 所有已知的磷的硫化物分子的四个磷原子都为四面体型排列(类似白磷)。[2] P4S2 也是已知的,不过在 −30 °C以上不稳定。[3]
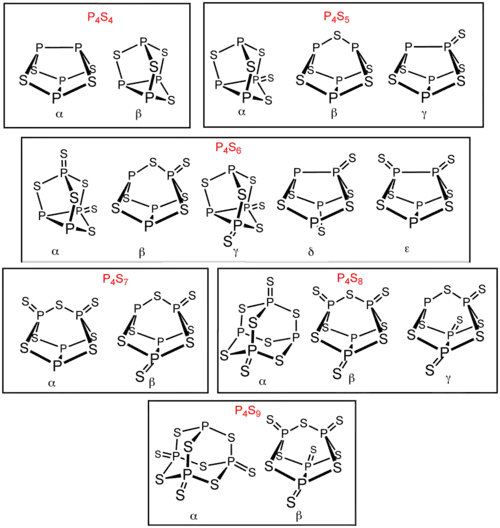
所有磷的硫化物的异构体
制备
磷的硫化物的主要制备方法是加热磷和硫的混合物。产物可以由 31P 核磁共振波谱法分析。更具选择性的合成需要用三苯基膦脱硫,或是用硫化三苯基胂硫化。[4][5]
P4S5
P4S5 可以由化学计量的 P4S3 和硫的二硫化碳溶液在光照和催化量的碘下反应而成。[8]产物可以通过使用磷-31核磁共振波谱法分析。
α-P4S5 可以通过 P4S10和红磷的光化学反应而成。[6] P4S5 是对热不稳定的,会在达到熔点之前歧化成 P4S3 和 P4S7。[9]
P4S6
P4S6 可以由 P4S7 被三苯基膦夺走一个硫原子而成:[6]
α-P4S5 和溶于二硫化碳的Ph3AsS 反应,也可以得到 α-P4S6。[4]两种新的六硫化四磷异构体δ-P4S6 和ε-P4S6可以由 α-P4S4 和溶于二硫化碳的Ph3SbS 反应而成。[10]
P4S8
β-P4S8可以由 α-P4S7 和溶于二硫化碳的 Ph3AsS 反应而成,会产生α-P4S7 和β-P4S8的混合物。[4]
参考资料
- Jason, M. E.; Ngo, T.; Rahman, S. . Inorg. Chem. 1997, 36 (12): 2633–2640. doi:10.1021/ic9614879.
- Holleman, A. F.; Wiberg, E. Inorganic Chemistry. Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- Heal, H. G. The Inorganic Heterocyclic Chemistry of Sulfur, Nitrogen, and Phosphorus Academic Press: London; 1980 ISBN 0-12-335680-6.
- Jason, M. E. . Inorg. Chem. 1997, 36 (12): 2641–2646. doi:10.1021/ic9614881.
- Nowottnick, H.; Blachnik, R. . Zeitschrift für anorganische und allgemeine Chemie. 1999, 625 (12): 1966–1968. doi:10.1002/(SICI)1521-3749(199912)625:12<1966::AID-ZAAC1966>3.0.CO;2-B.
- Catherine E. Housecroft; Alan G. Sharpe. . . Pearson. 2008: 484. ISBN 978-0-13-175553-6.
- "Phosphorus trisulfide" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 563.
- "Phosphorus pentasulfide" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 565.
- A. Earnshaw; Norman Greenwood. . . Butterworth Heinemann. 2002: 508. ISBN 0750633654.
- R. Bruce King. . . Wiley. 2005: 3711. ISBN 9780470862100.
- "Phosphorus heptasulfide" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 566.
- "Diphosphorus pentasulfide" in Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 567.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.