穆斯堡尔谱学
穆斯堡尔谱学(Mössbauer spectroscopy)是应用穆斯堡尔效应研究物质的微观结构的学科。穆斯堡尔效应即γ射线的无反冲共振吸收,于1957年由德国物理学家穆斯堡尔发现,并于次年得到实验验证。穆斯堡尔效应对环境的依赖性非常高,常利用多普勒效应对γ射线光子的能量进行调制,通过调整γ射线辐射源和吸收体之间的相对速度使其发生共振吸收。吸收率(或者透射率)与相对速度之间的变化曲线叫做穆斯堡尔谱。穆斯堡尔谱的能量分辨率非常高,可以用来研究原子核与周围环境的超精细相互作用。
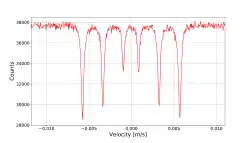
与核磁共振波谱法相似,穆斯堡尔谱学探测原子核能量水平的微小变化以响应其环境。 通常,可以观察到三种类型的核相互作用:异构体移位,在旧文献中也異構物位移位移; 四极分裂; 和磁超精细分裂(参见塞曼效应)。 由于伽马射线的高能量和极窄的线宽,穆斯堡尔光谱仪在能量(因此频率)分辨率方面是一种非常敏感的技术,能够检测到每1011个部分的变化。
应用
该技术的缺点之一是有限数量的伽马射线源和要求样品是固体以消除核的反冲。 穆斯堡尔谱对其对核的化学环境的细微变化的敏感性是独特的,包括氧化态变化,不同配体对特定原子的影响以及样品的磁环境。
作为一种分析工具,穆斯堡尔谱学在地质学领域特别有用,可用于识别包括流星和月球岩石在内的含铁样本的成分。 穆斯堡尔光谱的原位数据收集也在火星上富含铁的岩石上进行[1][2]。 在另一个应用中,穆斯堡尔谱法用于表征铁催化剂中的相变,例如用于费托合成的那些铁催化剂。 虽然最初由赤铁矿(Fe2O3)组成,但这些催化剂转变成磁铁矿(Fe3O4)和几种碳化三铁的混合物。 碳化物的形成似乎可以提高催化活性,但是它也会导致催化剂颗粒的机械破碎和磨损,这会导致催化剂最终从反应产物中分离出来[3]。
穆斯堡尔谱学中最常用的是57Fe的能量为14.4 keV 的γ射线,能量分辨率可以达到10-13;119Sn也经常用到。穆斯堡尔谱学在物理学、化学、生物学、地质学、冶金学、矿物学、地质学等领域都得到广泛应用。近年来穆斯堡尔谱学也在一些新兴学科,比如材料科学和表面科学领域,开拓了广泛的应用前景。
穆斯堡尔谱仪
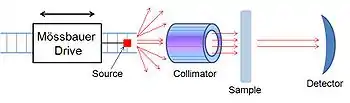
测量穆斯堡尔谱的仪器称为穆斯堡尔谱仪,由三个主要部件组成。一个移动的γ射线光源,用来产生多普勒效应;一个准直器得到平行光;以及一个检测器。
微型穆斯堡尔光谱仪,在美因茨大学开发并建造为“MIMOS II”,用于NASA的火星探测漫游者计划的两个火星车勇气号(Spirit, MER-A)和机遇号(Opportunity, MER-B)任务并分析火星岩石[7]。 除了明确的水证据之外,他们还发现了火星历史中一个阶段的证据,其中大气中含有的氧气比现在多得多。
另一个是只有拳头大小的装置应该在2013年与俄罗斯探测器"福布斯-土壤"一起落在火卫一上。 在探测器滞留在轨道后,她于2012年1月15日进入地球大气层并在东太平洋上空燃烧。
延伸阅读
- 贡泽尔:《穆斯堡尔谱学》科学出版社,1979.
- 夏元复,陈懿:《穆斯堡尔谱学和应用》科学出版社,1987.
- 陈义龙:《穆斯堡尔效应与晶格动力学》武汉大学出版社,2000.
参考资料
- Klingelhöfer, G. . Hyperfine Interactions. 2004, 158 (1–4): 117–124. Bibcode:2004HyInt.158..117K. doi:10.1007/s10751-005-9019-1.
- Schröder, Christian. . Spectroscopy Europe. 2015, 27 (2): 10 [2018-01-08]. (原始内容存档于2018-01-08).
- Sarkar, A.; et al. . Catalysis Letters. 2007, 121 (1–2): 1–11. doi:10.1007/s10562-007-9288-1.
- Martinho, M., Munck, E., "57Fe Mossbauer spectroscopy in chemistry and biology," in 2010, John Wiley & Sons, Inc. doi:10.1002/9780470602539.ch2
- Schuenemann, V., Paulsen, H., "Moessbauer spectroscopy," in 2007, John Wiley & Sons Ltd. ISBN 978-0-470-03217-6.
- Miquel Costas, Mark P. Mehn, Michael P. Jensen, and Lawrence Que, Jr. "Dioxygen Activation at Mononuclear Nonheme Iron Active Sites: Enzymes, Models, and Intermediates" Chem. Rev., 2004, 104 (2), pp 939–986. doi:10.1021/cr020628n
- Klingelhöfer, G.; et al. . Hyperfine Interactions. 2002, 144 (1–4): 371–379. Bibcode:2002HyInt.144..371K. doi:10.1023/A:1025444209059.