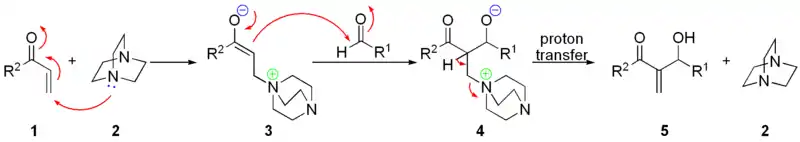
贝里斯-希尔曼反应
贝里斯-希尔曼反应(Baylis–Hillman reaction),是α,β-不饱和化合物与亲电试剂(醛、酮)在合适的催化剂作用下,生成烯烃α-位加成产物的反应。催化剂一般采用DABCO(1,4-二氮杂双环[2,2,2]辛烷的缩写形式,俗称:三亚乙基二胺),生成物为烯丙基醇[1]。这一反应又被称为森田-贝里斯-希尔曼反应(Morita–Baylis–Hillman reaction),或者简称为MBH反应(MBH reaction)[2],这一反应名称得名自日本化学家森田健一(Ken-ichi Morita)、英国化学家安东尼·贝里斯(Anthony B. Baylis)和德国化学家梅维尔·希尔曼(Melville E. D. Hillman)。
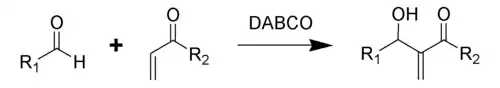
贝里斯-希尔曼反应
后来,亲电试剂扩展到亚胺类sp2型碳的亲电试剂,称为氮杂-贝里斯-希尔曼反应[3]。
反应底物中的亲电试剂可以是醛、亚胺、亚胺盐以及活化的酮。α,β-不饱和化合物(活化烯烃)可以是丙烯酸酯、丙烯醛、乙烯基酮、丙烯腈、α,β-不饱和砜、亚砜、亚胺以及α,β-不饱和环烯酮等缺电子烯烃。
反应特点
参见
参考资料
- Baylis, A. B.; Hillman, M. E. D. German Patent. 1972. 缺少或
|title=为空 (帮助) 2,155,113. - Morita, K.; Z. Suzuki, H. Hirose. Bull. Chem. Soc. Jpn. 1968, 41 (2815). 缺少或
|title=为空 (帮助) - Perlmutter, P.; Teo, C. C. Tetrahedron Lett. 1984, 25 (5951). 缺少或
|title=为空 (帮助) - Basavaiah, D.; Rao, P. D.; Hyma, R. S. Tetrahedron. 1996, 52: 8001. 缺少或
|title=为空 (帮助)(综述) - Ciganek, E. Org. React. 1997, 51 (201). 缺少或
|title=为空 (帮助)(综述) - Hill, J. S.; Isaacs, N. S. J. Phys. Org. Chem. 1990, 3 (285). 缺少或
|title=为空 (帮助) - Iwabuchi, Y.; Nakatani, M.; Yokoyama, N.; Hatakeyama, S. J. Am. Chem. Soc. 1999, 121 (10219). 缺少或
|title=为空 (帮助) - Iura, Y.; Sugahara, T.; Ogasawara, K. Org. Lett. 2001, 3 (291). 缺少或
|title=为空 (帮助) - Shi, M.; Xu, Y.-M. Angew. Chem. Int. Ed. 2002, 41 (4507). 缺少或
|title=为空 (帮助)
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.