過渡態類似物
過渡態類似物為在酵素催化反應中,和基質分子的過渡狀態有相似化學結構的化合物。[1] 理論顯示酵素抑制劑像過渡態的結構。[2]過渡態類似物可藉由鍵結於酵素活化位,作為酵素反應的酵素抑制劑。像是藥物就是過渡態的類似物抑制劑,包含流感藥物,像是神經胺酸酶抑制劑,奧司他韋;蛋白酶抑制劑,沙奎那韋。
過渡狀態
過渡狀態的結構可以透過統計力學描述,統計力學是在描述鍵的打斷或形成,使過渡狀態回到反應物,或是變成產物。在酵素催化反應中,當酵素可以穩定高能的過渡狀態中間物時,反應的活化能會很低。過渡態類似物模仿這些高能的中間物,但是沒有走這些催化反應,且會比基質和產物的類似物和酵素鍵結的更緊。
設計過渡狀態類似物
要設計過渡狀態類似物,其關鍵步驟為決定和酵素作用下,基質的過渡狀態結構。像是,動力學同位素效應。此外,其過渡態類似物的結構,也可以透過類似和動力學的同位素互補的計算方法預測出來。以下兩個簡單的方法介紹。
設計過渡狀態類似物例子
在利用KIE或是電腦模擬器決定過渡態的結構後,抑制劑就可以根據過渡態的結構以及中間產物設計出來。接下來的例子說明,抑制劑如何藉由改變官能基所對應的過渡態的幾何結構和電子分布,模仿過渡態的結構。
甲硫核苷酶抑制劑
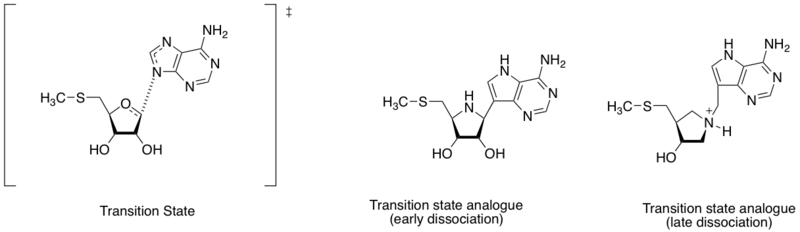
甲硫核苷酶為一種酵素,可以催化5'-methylthioadenosine 和S-adenosylhomocysteine的水解脫腺苷酸化的反應。甲硫核苷酶也被視為抗細菌藥物發現的目標,因為甲硫核苷酶對於細菌代謝系統是非常重要的,且也只有細菌會產生。[7]視腺嘌呤的氮和核醣的碳距離不同,過渡態的結構可藉由早期或晚期的解離程度決定。根據找到不同的過渡態結構,Schramm和他的同事設計了兩個過渡態類似物,模仿早期即晚期的解離過渡態。早期即晚期的解離過渡態展現了個別的解離常數,約在360~140pM。[8]
嗜熱菌蛋白酶抑制劑
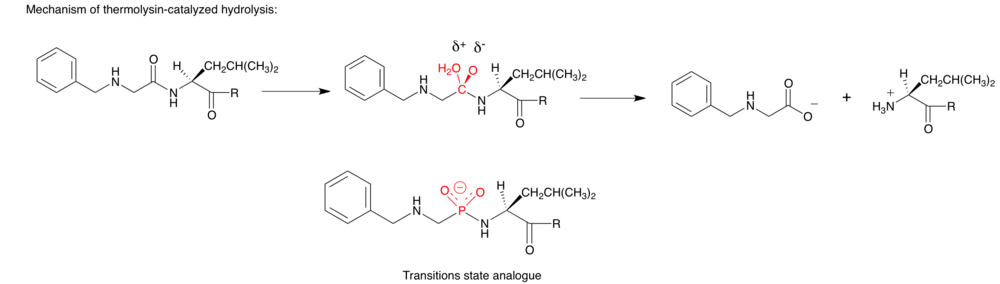
嗜熱菌為一種酵素,可以水解由芽孢桿菌屬所產生的疏水性胺基酸,所含有的肽酰胺鍵。[9]因此,他也是一種設計抗菌的目標媒介。這個酵素反應的機制,從小的多肽分子取代水分子的鋅鍵結朝向嗜熱菌的Glu143。水分子可被鋅離子和Glu143活化,攻擊四面體過渡態的羰基碳。Holden和他的夥伴,就開始設計模仿一系列的磷酸酰胺化肽類似物。在這些合成的類似物中,R = L-Leu為具有最有效的抑制劑活性(Ki = 9.1 nM)。[10]
精氨酸酶抑制劑
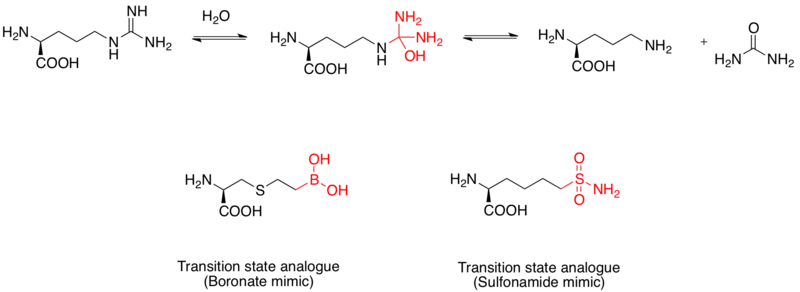
精氨酸酶是一種有雙核的錳金屬蛋白,可以催化水解L型的精胺酸到L型的鳥胺酸以及尿素。他也被視為治療哮喘的藥物標靶。[11]這個水解左旋精胺酸的機制是藉由水分子的親和攻擊,而形成一四面體過渡態。研究顯示,硼酸的部分採用四面體結構,作為一種抑制劑。此外,磺醯胺官能基,也可以模仿過渡態的結構。[12]硼酸模仿過渡態類似物抑制劑,是藉由X光照射人類精胺酸所產生的金體結構所證明。[13]
參考資料
- Silverman, Richard B. . San Diego, CA: Elsevier Academic Press. 2004. ISBN 0-12-643732-7.
- Copeland, R.A.; Davis, J.P.; Cain, G.A.; Pitts, W.J.; Magolda, R.L. . Biochemistry. 1996, 35 (4): 1270. doi:10.1021/bi952168g.
- Schramm, Vern L>. . Annu. Rev. Biochem. 2011, 80: 703–732. PMID 21675920. doi:10.1146/annurev-biochem-061809-100742.
- Peter, Kollman; Kuhn, B. & Peräkylä, M. . J. Phys. Chem. B. 2002, 106 (7): 1537–1542. doi:10.1021/jp012017p.
- Hou, G; Hou, G. & Cui, Q. . J. Am. Chem. Soc. 2011, 134 (1): 229–246. doi:10.1021/ja205226d.
- Schwartz, S; Saen-oon, S.; Quaytman-Machleder, S.; Schramm, V. L. & Schwartz, S. D. . PNAS. 2008, 105 (43): 16543–16545. Bibcode:2008PNAS..10516543S. doi:10.1073/pnas.0808413105.
- Singh, Vipender; Singh V, Lee JE, Núñez S, Howell PL, Schramm VL. . Biochemistry. 2005, 44 (35): 11647–11659. PMID 16128565. doi:10.1021/bi050863a.
- Guitierrez, Jemy; Luo, M., Singh, V., Li, L., Brown, R. L., Norris, G. E. . ACS chemical biology. 2007, 2 (11): 725–734. PMID 18030989. doi:10.1021/cb700166z.
- S, Endo. . J. Ferment. Technol. 1962, 40: 346–353.
- Holden, Hazel; Tronrud, D. E., Monzingo, A. F., & Weaver, L. H. . Biochemistry. 1987, 26 (26): 8542–8553. doi:10.1021/bi00400a008.
- Maarsingh, Harm; Johan Zaagsma, Herman Meurs. . Br J Pharmacol. October 2009, 158 (3): 652–664. PMC 2765587
 . doi:10.1111/j.1476-5381.2009.00374.x.
. doi:10.1111/j.1476-5381.2009.00374.x. - E, Cama; Shin H, Christianson DW. . J Am Chem Soc. 2003, 125 (43): 13052–7. doi:10.1021/ja036365b.
- Shishova, Ekaterina; Luigi Di Costanzo, David E. Cane, and David W. Christianson. . Biochemistry. 2009, 48 (1): 121–131. doi:10.1021/bi801911v.