锌化合物
无机化合物
氧族元素化合物




氧化锌(ZnO)在常温下是白色固体,高温下失去部分氧而变黄。[5]氧化锌是两性氧化物,可溶于酸形成Zn2+;溶于碱形成[Zn(OH)4]2-。[6]
- ZnO + 2 HCl → ZnCl2 + H2O
- ZnO + 2 NaOH + H2O → Na2[Zn(OH)4]
硫化锌(ZnS)可由单质化合或高温下由硫化氢和氧化锌反应得到。它主要以闪锌矿和纤锌矿两种结构存在。[7]硒化锌(ZnSe)是黄色晶体,它和硫化锌一样,是一种半导体材料,可由单质化合得到,或加热硒、氧化锌和硫化锌的混合物制备。[8]碲化锌(ZnTe)是红褐色晶体,掺杂后可用于光电子学研究。[9]
硫酸锌(ZnSO4)是白色固体,高温下分解,产生ZnO烟尘并放出SO2。它可由含锌物质和硫酸反应得到:[10]
- Zn + H2SO4 → ZnSO4 + H2↑
- ZnO + H2SO4 → ZnSO4 + H2O
配合物
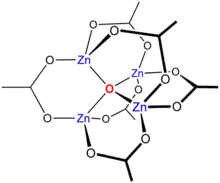
4(μ4-O)(η2-O
2CCH
3)
6]的结构
锌配合物最常见的几何构型是四面体构型,这和其配合物符合八电子规则有关。尽管如此,八面体结构的配合物在过渡金属中是很常见的。根据Ahrland等人的分类,Zn2+属于A类受体,[17]相比于第三周期的硫和磷来说,它能和第二周期的氧和氮元素的化合物形成更稳定的配合物。在HSAB理论中,由於Zn2+電荷密度高,它被歸納為硬酸。
在水溶液中,[Zn(H2O)6]2+是锌离子的主要物种。[18]锌离子具有弱酸性,这可归因于[Zn(H2O)6]2+(pKa≈9)的水解作用:[19]
- [Zn(H2O)6]2+ ⇌ [Zn(H2O)5(OH)]+ + H+
锌可以和卤素或拟卤素形成配阴离子[ZnX3]−和[ZnX4]2−(X=Cl,Br,I,CN和SCN)。硫氰酸根配合物表明了锌的A类受体性质,形成的是N-键合配合物[Zn(NCS)4]2−,而同族的镉形成S-键合配合物[Cd(SCN)4]2−。
锌的二配位化合物出现在锌的胺盐中,如Zn(NR1R2)2(R1=CMe3, R2=SiMe3),由于配体位阻大,没有足够的空间容纳更多的相同配体。[20]
有机锌化合物
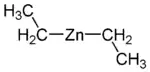
含有Zn-C键的化合物是有机锌化合物。二乙基锌((C
2H
5)
2Zn)最初于1848年被报道,它可由锌和碘乙烷反应得到,也是第一个已知的含金属-碳键的σ键化合物。[21]
一价锌的有机化合物含有金属-金属键,[Zn2(η5–C5Me5)2]便是其中一例,该化合物于11°C分解。[22]
参考文献
- Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils. . 91–100. Walter de Gruyter. 1985: 1034–1041. ISBN 3-11-007511-3 (德语).
- Greenwood, N. N.; Earnshaw, A. 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- Housecroft, C. E.; Sharpe, A. G. 3rd. Prentice Hall. 2008. ISBN 978-0131755536.
- Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred, 6th, New York: Wiley-Interscience, 1999, ISBN 0-471-19957-5
- Wiberg, E. & Holleman, A. F. (2001). Inorganic Chemistry. Elsevier. ISBN 0-12-352651-5.
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 0-08-037941-9.
- Wells A.F. (1984) Structural Inorganic Chemistry 5th edition. Oxford Science Publications. ISBN 0-19-855370-6
- Georg Brauer. Handbuch der Präparativen Anorganischen Chemie. Band II, 1978, ISBN 3-432-87813-3, S. 1028.
- Amin, N.; Sopian, K.; Konagai, M. . Solar Energy Materials and Solar Cells. 2007, 91 (13): 1202. doi:10.1016/j.solmat.2007.04.006.
- Dieter M. M. Rohe, Hans Uwe Wolf "Zinc Compounds" in Ullmann's Encyclopedia of Industrial Chemistry 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a28 537
- Srivastava, O. K.; Secco, E. A. (pdf). Canadian Journal of Chemistry. 1967, 45 (6): 579–583 [2017-11-03]. doi:10.1139/v67-096. (原始内容存档于2019-07-10).
- Furnell, B. S. (1989). Vogel's Textbook of Practical Organic Chemistry (5th ed.). New York: Longman/Wiley.
- Shriner, R. L.; Fuson, R. C. (1956). The Systematic Identification of Organic Compounds (5th ed.). New York: John Wiley. pp. 117–119. OCLC 732878490 (页面存档备份,存于).
- Chkirate K, Regragui R, Essassi Ε M, et al. Crystal structure of diaquabis[N-2-aminophenyl-5-methyIpyrazol-yl acetamido] zinc(II) diperchlorate, C24H24N8O4Zn(ClO4)2[J]. Zeitschrift für Kristallographie - New Crystal Structures, 2001, 216(1-4):669-670.
- Shivani, Gulhane R, Chakraborti A K. Zinc perchlorate hexahydrate [Zn(ClO4)2·6H2O] as acylation catalyst for poor nucleophilic phenols, alcohols and amines: Scope and limitations[J]. Journal of Molecular Catalysis A Chemical, 2007, 264(1–2):208-213.
- Demir A S, Mustafa E. Zinc Perchlorate Catalyzed One‐Pot Amination—Annulation of α‐Cyanomethyl‐β‐ketoesters in Water. Regioselective Synthesis of 2‐Aminopyrrole‐4‐carboxylates.[J]. Tetrahedron, 2006, 62(7):1452-1458.
- Ahrland, S.; Chatt, J.; Davies, N. R. . Quart. Rev. 1958, 12: 265–276. doi:10.1039/QR9581200265.
- Burgess, J. Metal ions in solution, (1978) Ellis Horwood, New York. p 147
- Baes, C. F.; Mesmer, R. E. The Hydrolysis of Cations, (1976), Wiley, New York
- Rees, W. S.; Green, D. M.; Hesse, W. . Polyhedron. 1992, 11: 1697–1699. doi:10.1016/S0277-5387(00)83726-2.
- E. Frankland. . Quarterly Journal of the Chemical Society. 1850, 2: 263. doi:10.1039/QJ8500200263.
- Resa, I.; Carmona, E.; Gutierrez-Puebla, E.; Monge, A. . Science. 2004, 305 (5687): 1136–8. Bibcode:2004Sci...305.1136R. PMID 15326350. doi:10.1126/science.1101356.
