键三角
键三角,又称van Arkel-Ketelaar图或van Arkel-Ketelaar三角。键三角通过二元化合物(或单质)的电负性来确定该物质离子键、共价键和金属键的成分。键三角的横、纵坐标分别是两种元素的电负性和、差。三个顶点分别代表着离子键、共价键、金属键。
三角表明物质的键型通常不是单一的,而是多种键型混杂。
键三角的发展史
早期非定量键三角
很久以前化学家们就认识到化学键可以分为三种典型类型:离子键、共价键和金属键。
1928年Grimm图
1928年Grimm将二元化合物按照阴阳离子的族序数列出下表。横坐标为阳离子的族序数,纵坐标为阴离子的族序数。
表中划分了四个区域,分别代表不同类型的化合物或单质。
- A = Atommoleküle (molecular),为分子型化物质。
- D = Diamantartige Stoffe (diamond like),为类金刚石物质。
- M = Metalle (metal),为金属型物质。
- S = Salze (salt),为盐型化合物
1935年Fernelius和Robey的键三角
该图列的三个顶点分别代表化合物或单质的三种典型键型:金属、共价和离子,以及说明了典型键型之间有过渡物质。
1941年van Arkel的键三角
van Arkel将键三角的边上也填入物质。
1947年Ketelaar的键三角
van Arkel的键三角被Ketelaar改进。
1985年Jolly的键三角
键三角内部和边界上的化合物可以有不同的选择。William Jolly根据自己选择的物质给出了一个新的键三角。
1994年Sproul的键三角
1994年Sproul给出了同样使用构造能CE作为坐标的键三角,并且给出了键型的边界。
1995年Jensen的定量键三角
Willam Jensen在他1995年中的论文中回顾了键三角,同时介绍了一种横纵坐标皆使用Martynov & Batsanov 电负性作为参数的键三角。横坐标为两元素电负性的平均值,纵坐标为电负性之差的绝对值。
另一种Jensen三角则使用了Pauling电负性。
2005年Meek和Garner的键三角
该图像给出了边界的划分,并且给以理论依据,同时也对边界上的物质给以性质区分。
键三角中键型边界的划分
早期直线边界
Allen和Sproul都认为键三角键型的边界可以用直线表示。Sproul给出了定量的边界:
- 共价-离子边界:χav=0.5Δχ+1.60
- 金属-非金属边界:χav=-0.5Δχ+2.28
由于共价-离子边界正好位于所有含铝化合物连线的下方,金属-非金属边界位于所有含磷化合物连线和含氢化合物连线的下方,可以得到以下结论:
- 所有电负性大于Al的元素都不能显阳离子性。但Hg, Ga, In, Tl, Sn和Pb在某些化合物中显阳离子性。
- 所有电负性小于等于铝的元素,与电负性大于等于磷的元素形成的物质显离子型。
- 电负性小于氢的元素不会显阴离子性。
- 电负性小于氢的两种元素显金属性,但有时为准金属或半导体。
但键三角仍然存在诸多局限:
改进后的边界
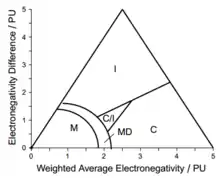
共价-离子边界
判断化合物离子或是共价性质的依据是局部电荷。 对于双原子分子AB的单键,Wilmshrust提出A原子上的局部电荷qA可以表示为:
因此:
其中和分别代表A、B原子的电负性。 至少有其余4个公式可以等价地推出上述结论。Smith使用了电负性平衡的方法:
其中,
可以导出:
该公式表明,带有相同局部电荷qA的化合物具有相同的Δχ:χav值,因此所有离子-共价性相同的物质排列在一条过原点,斜率为2q的直线上。
但是该方法并只考虑了单键,没有考虑到键级。
金属-非金属边界
衡量金属性的重要参数是能带间隙Eg,因为导电性与exp(-Eg/kT)成正比。具有较小Eg的物质为金属导体,具有较大Eg的物质则为绝缘体。
具有相近平均电负性的物质,能隙随着电负性之差的增大而增大;电负性之差相近时,能隙随着平均电负性的增大而增大。
Phillips和van Vechten提出,对于具有八电子结构的晶体,每个单元AB具有的能隙可以由如下公式计算:
- Eg2=Ei2+Ec2。
其中Ei、Ec分别代表能隙的离子贡献和共建贡献。
Adam用他的公式重新定义了这种联系:
- Eg2=Eh2+C2
其中C为电荷转移能,与Δχ成正比;Eh2代表同极能量间隙,被定义为价带到导带的能量间隙。Eh2是原子间相互作用的一种度量,因此与平均电负性χav有关。
根据此公式,具有相同能带间隙的物质会排布在曲线:c1Δχ2+c2χav2=k上,若Δχ和χav对于能带间隙具有相同的贡献,曲线将是圆的一段弧;若不是,则曲线将是椭圆的一段弧。
针对多原子分子的改进
键三角的一个异常之处是:由相同两种元素组成的化合物,即便价态不同,仍然在键三角中具有相同的位置。 例如:Ti(IV)的卤化物主要为共价性,但Ti(II)主要为离子型。 这是由于对于多原子分子相比双原子分子,局部电荷qA与Δχ、χav的关系更加复杂。 对于多原子分子来说,使用平均电负性χav作为标度不再合适,因此对多原子分子AmBn,需要定义一个新的平均电负性(χav)w,即为加权平均电负性:
使用加权平均电负性后,
其中斜率Δχ:(χav)w不再严格地与原子所带电荷相关。A原子上所带电荷由下列公式给出:
使用加权平均电负性后,同样两种元素不同价态的物质将显示出区别,如:PbF4和PbF2的(χav)w分别为3.73和3.41个鲍林单位。
参考资料
- Meek, Terry L.; Garner, Leah D. . J. Chem. Educ.. 2005, 82 (2): 325–333 [2014-11-24]. doi:10.1021/ed082p325. (原始内容存档于2019-07-10).