1,2-重排反应
1,2-重排或1,2-遷移或1,2-移位或特莫爾1,2-移位是一種有機反應,從化學化合物的其中一個原子的取代基移動到的另一個原子上。一個1,2移位運動為兩個相鄰的原子相較於移動越過較大距離是可能的。例如,從碳原子C2上的取代基R移動到C3上的例子。

重排是分子內的作用,起始化合物和反應產物是結構異構物。1,2-重排屬於一大類的化學反應稱為重排反應。 涉及氫原子重新排列被稱為1,2-氫化移。如果重新排列的取代基是烷基,則它被命名為根據該烷基的陰離子:即1,2-甲基化位移,1,2-乙基化位移等等。
反應機制
1,2-重排反應通常是起始於反應中間體的形成,如:
- 在親核性的重排反應或陰離子轉移重排反應中的碳陽離子異種溶解
- 在親電子性重排反應或陽離子轉移重排反應中的碳陰離子
- 自由基同種溶解(均裂)。
- 硝基苯抽出物
在重排反應的第二個步驟,取代基位移的驅動力為去形成一個更穩定的中間體,例如一個三級碳陽離子會比二級碳陽離子來的更穩定,因此,如果用三級結構的新戊基溴經SN1反應得到的乙醇產量,會比用一級的來的多。
碳陽離子的重排比負碳離子或自由基的對應更為常見。該現象可以用休克爾規則來解釋,一個環狀碳陽離子的過渡態具芳香性而且是穩定的,因為它擁有2個電子。另一方面,在陰離子過渡態是有4個電子存在的,這樣是具反芳香性而且不穩定,一個自由基的過渡狀態既不為不穩定也不為穩定。
最重要的碳正離子1,2-重排反應為瓦格纳-梅爾外因重排反應,而碳陰離子1,2-重排反應則為二苯乙醇酸重排反應。
自由基的1,2-重排反應
最早的自由基1,2-重排反應為1911年海因里希·奧托·威蘭所發表的,為雙(三苯基甲基)過氧化物1至四苯基乙烷2的轉化率。
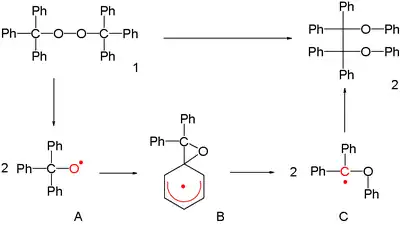
反應的進行是通過三苯甲基自由基A,以 2-(苯氧基甲基)-1,1-二苯基自由基C及其二聚體進行重排反應。目前還不清楚是否這個重排的環己二烯基自由基中間體B為過渡狀態或反應中間體,因為它(或任何其它此類種化合物)由ESR光譜進行檢測但迄今未能實現。
一個不太常見的自由基1,2-移位的例子可以在某些多環芳香族化合物的氣相熱解過程中找到。1,2-重排反應的芳香基所需要的能量(可達60千卡/莫耳或250千焦耳/莫耳),但比要求的質子化作用而形成芳香炔少得多(82千卡/莫耳或340千焦耳/莫耳)。因此在烯烴自由基的質子化炔為首選。

1,2-重排反應
以下的各種反應機制為1,2-重排反應:
1,3-重排反應
1,3-重排反應,反應產生的距離超過3個碳原子。 例如:
- 弗賴斯重排反應
- 馬鞭草烯酮的1,3-二烷基轉移到菊油環酮上
參考文獻
- Whitmore, Frank C. (1932). "The common basis of molecular rearrangementsJ. Am. Chem. Soc.54 (8): 3274–3283. doi(页面存档备份,存于):10.1021/ja01347a037 (页面存档备份,存于).
- Über Triphenylmethyl-peroxyd. Ein Beitrag zur Chemie der freien Radikale Wieland, H. Chem. Ber. 1911, 44, 2550–2556. doi(页面存档备份,存于):10.1002/cber.19110440380(页面存档备份,存于)
- Isomerization of Triphenylmethoxyl and 1,1-Diphenylethoxyl Radicals. Revised Assignment of the Electron-Spin Resonance Spectra of Purported Intermediates Formed during the Ceric Ammonium Nitrate Mediated Photooxidation of Aryl Carbinols K. U. Ingold, Manuel Smeu, and Gino A. DiLabio J. Org. Chem.; 2006; 71(26) pp 9906–9908; (Note) doi(页面存档备份,存于):10.1021/jo061898z
- Brooks, Michele A.; Lawrence T. Scott (1999). "1,2-Shifts of Hydrogen Atoms in Aryl Radicals". J. Am. Chem. Soc. Soc. 121 (23): 5444–5449. doi(页面存档备份,存于):10.1021/ja984472d。