奥威尔斯合成
奥威尔斯合成(Auwers合成)是苯并呋喃与苯甲醛发生缩合、溴化生成2-溴-2-(α-溴苄基)苯并呋喃酮,然后经醇碱处理重排,转变为黄酮醇的反应。由卡爾·馮·奧威爾斯于1908年发现。[1]

由于这个反应对反应物和产物的结构要求都比较高,并且反应物二溴化物比较难制备,产率也不是很高(70%),因此它在有机合成中的应用并不十分广泛。一个应用的例子见下图:

反应机理
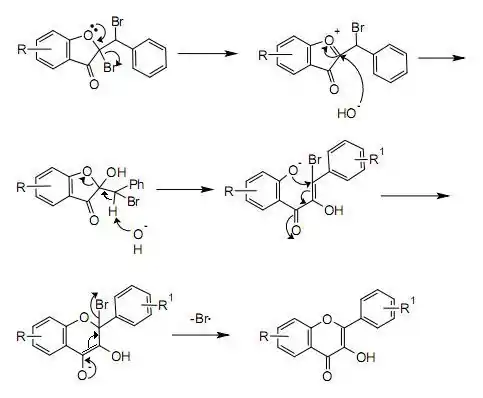
一个可能的机理如下图所示。氧原子上的孤对电子使溴离子离去,生成被氧原子稳定的碳正离子,然后氢氧根进攻,得到一个具有半缩酮结构的中间体。此中间体发生分子内E1cB反应,氢离子被夺去,接着氧负对不饱和酮进行麦克尔加成,新生成的烯醇负离子再将剩下的一个溴离子挤出去,得到最终产物。
当原料苯并呋喃环中的氧原子有间位的取代基(如甲基、甲氧基)时,产物不是黄酮醇,而是2-苯甲酰基苯并呋喃酮的衍生物。[2][3][4][5][6]

Auwers合成 例外
参见
注释
- K. v. Auwers et al. Ber. 1908, 41, 4233.
- K. v. Auwers et al. Ber. 1915, 48, 85.
- K. v. Auwers et al. Ber. 1916, 49, 809.
- K. v. Auwers, P. Pohl, Ann. 1914, 405, 243.
- Dean, H. F.; Nierenstein M. J. Am. Chem. Soc. 1925, 47, 1676.
- Kalff, J.; Robinson, R. J. Chem. Soc. 1925, 1968.
参考资料
- Minton, T. H.; Stephen, H. J. Chem. Soc. 1922, 121: 1598.
- Ingham, B. H.; Henry, S.; Ronald, T. J. Chem. Soc. 1931: 895.
- Wawzonek, S. Heterocyclic Compounds, 1951, 2: 245.
- Philbin, E. M.; O'Sullivan, W. I. A.; Wheeler, T. S. J. Chem. Soc. 1954, 245: 4174.
- Bird, C. W.; Cookson, R. C. J. Org. Chem. 1959, 24: 441.
- 汪秋安.《重要有机化学反应及机理速查手册》.ISBN 978-7-5064-4063-9
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.