卡罗尔重排反应
反应机理
反应最初是用碱催化,采用一锅反应,即酯交换(制取β-酮酯)-卡罗尔重排串联进行,需要苛刻条件(乙酸钠,170-240℃)。其机理为烯醇发生的克莱森重排然后脱羧(下图A途径)。现多采用分步方法进行,主要改进包括双负离子法(用二异丙基氨基锂生成双负离子,然后在室温或回流下重排,由此得到的酮酸较易分离)[2][3]以及负载在氯化铝上无溶剂条件下的反应[4]。
1980年辻二郎对此反应作了改进,他用钯(0)作催化剂,经过生成中间体烯丙基正离子/羧酸根负离子有机金属配合物,然后脱羧和烯丙基化,实现了温和条件下的卡罗尔重排(下图B途径)。[5]
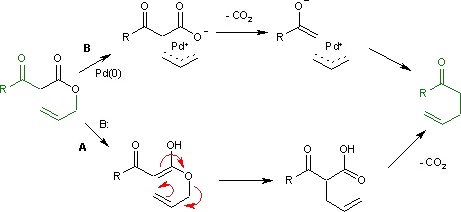
卡罗尔重排的机理
下面用四(三苯基膦)钯(0)催化的实验证实了脱羧一步是在烯丙化前发生。[6]
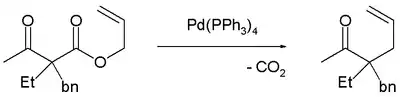
脱羧烯丙基化
不对称脱羧烯丙化反应
使用手性配体的不对称卡罗尔重排也有发展。[7] 首个不对称重排由 Burger 等在 2004 年报道,是以三(二亚苄基丙酮)二钯(0)和Trost配体催化:[6]
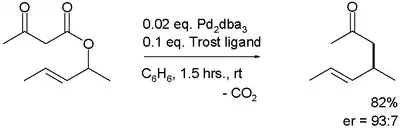
烯醇负离子的不对称烯丙化
桑野良一等报道了萘酚存在下的卡罗尔重排,反应ee可达88%,但缺点是底物必须要含乙酰氨基基团。[8]
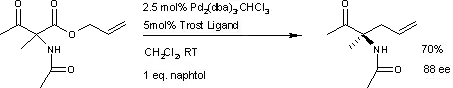
桑野良一的不对称卡罗尔重排
又如如下对映归一性合成:[9]
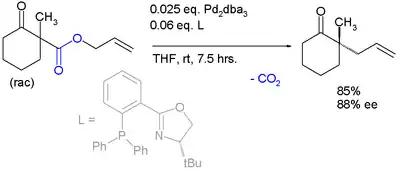
莫尔的不对称卡罗尔重排
不对称卡罗尔重排也可拓展至烯醇的碳酸酯发生的α-烯丙基化。[10]
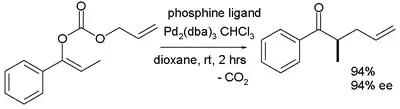
2005年特罗斯特的脱羧烯丙化
参考资料
- Carroll, M. F. . J. Chem. Soc. 1940: 704–706. doi:10.1039/JR9400000704.
- J. F. Genus, D. D. Peters, J-F. Ding, T. A. Bryson. . Synlett. 1994: 209–210. doi:10.1055/s-1994-22797.
- Stephen R. Wilson, Martyn F. Price. . J. Org. Chem. 1984, 49 (4): 722–725. doi:10.1021/jo00178a036.
- S. I. Pogrebnoi, Y. B. Kalyan, M. Z. Krimer, W. A. Smit. . Tetrahedron Lett. 1987, 28 (41): 4893–4896. doi:10.1016/S0040-4039(00)96654-1.
- Isao Shimizu, Toshiro Yamada and Jiro Tsuji. . Tetrahedron Letters. 1980, 21 (33): 3199–3202. doi:10.1016/S0040-4039(00)77444-2.
- Erin C. Burger and Jon A. Tunge. . Org. Lett. 2004, 6 (22): 4113–4115. doi:10.1021/ol048149t.
- Shu-Li You and Li-Xin Dai. . Angew. Chem. Int. Ed. 2006, 45 (32): 5246–5248. doi:10.1002/anie.200601889.
- Kuwano, R.; Ishida N.; Murakami, M. . Chem. Commun. 2005, (31): 3951–3952. doi:10.1039/b505105c..
- Justin T. Mohr, Douglas C. Behenna, Andrew M. Harned, and Brian M. Stoltz. . Angew. Chem. Int. Ed. 2005, 44 (42): 6924–6927. doi:10.1002/anie.200502018.
- Barry M. Trost and Jiayi Xu. . J. Am. Chem. Soc. 2005, 127 (49): 17180–17181. doi:10.1021/ja055968f.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.