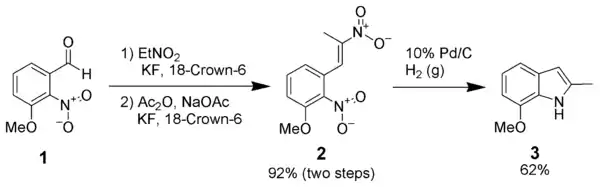
Leimgruber-Batcho吲哚合成
Leimgruber-Batcho吲哚合成(Leimgruber-Batcho indole synthesis)
首先邻硝基甲苯与N,N-二甲基甲酰胺二甲缩醛和吡咯烷反应得到烯胺 (2),[4] 然后烯胺再发生还原环化,得到吲哚衍生物。
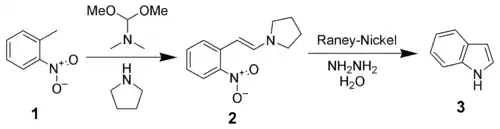
Leimgruber-Batcho吲哚合成
反应机理
首先二甲基甲酰胺二甲缩醛受到吡咯烷的亲核进攻,二甲胺离去,产生一个活性更强的试剂。它受到邻硝基甲苯甲基氢去质子化形成的碳负离子的进攻,失去甲醇,得到上述烯胺。反应的此一步也可在无吡咯烷的条件下进行,这时反应经过N,N-二甲基烯胺中间体,不过所需反应时间通常较长。这一步的产物烯胺类似于一种分别在两侧连有吸电子和供电子取代基的烯烃(Push-pull olefin),极性较强,而且常因分子中较大的共轭范围而呈深红色。
反应的第二步中硝基在氢气作用和雷尼镍催化下被还原为氨基,接着环化并消除吡咯烷得到最终产物。一般是利用水合肼试剂在镍存在下自发分解相应单质的反应,而在反应中原位生成氢气并进行反应。
此反应原料邻硝基甲苯(衍生物)易得,反应条件温和,产率较高,因此常用作Fischer吲哚合成的替代方法。可以通过此反应来合成有生理活性的吲哚衍生物。
变体
参考资料
- Batcho, A. D.; Leimgruber, W. 美國專利第3,732,245号 & 美國專利第3,976,639号
- Batcho, A. D.; Leimgruber, W. Org. Synth. 1985, 63, 214-220. (Article (页面存档备份,存于))
- Clark, R. D.; Repke, D. B. Heterocycles 1984, 22, 195-221. (Review)
- Maehr, H.; Smallheer, J. M. J. Org. Chem. 1981, 46, 1753. (doi:10.1021/jo00321a053)
- Garcia, E. E.; Fryer, R. I. J. Heterocycl. Chem. 1974, 11, 219.
- Ponticello, G. S.; Baldwin, J. J. J. Org. Chem. 1979, 44, 4003. (doi:10.1021/jo01336a065)
- Chen, B.-C.; Hynes, Jr., J.; Randit, C. R.; Zhao, R.; Skoumbourdis, A. P.; Wu, H.; Sundeen, J. E.; Leftheris, K. Heterocycles 2001, 55, 951.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.