西蒙斯–史密斯反应
Simmons–Smith反应(西蒙斯-史密斯反应)是烯烃或炔烃与类卡宾发生反应生成环丙烷环系的有机反应。[1][2][3] 此反应以发现者Howard Ensign Simmons, Jr.和R. D. Smith命名。
| 西蒙斯-史密斯反應 | |
|---|---|
 正在進行的西蒙斯-史密斯反應 |
| 西蒙斯-史密斯反應 | |
|---|---|
| 命名根据 | Howard Ensign Simmons, Jr. Ronald D. Smith |
| 反应类型 | 成环反应 |
| 标识 | |
| 有机化学网站对应网页 | simmons-smith-reaction |
| RSC序号 | RXNO:0000258 |
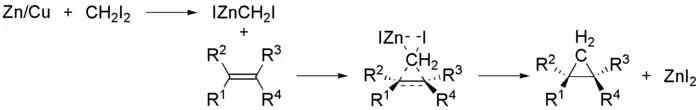
这个反应用到的类卡宾试剂称为Simmons-Smith试剂,是个有机锌化合物,通式X(CR1R2)ZnY,一般为碘化碘甲基锌(ICH2ZnI)。它一般通过1,1-二卤化物与锌铜偶(Zn(Cu))在醚类溶剂中反应制取。最常用的1,1-二卤代烃为二卤甲烷,如二碘甲烷。锌铜偶由锌粉在硫酸铜的酸性溶液中处理活化而得。也可以用二乙基锌代替锌铜偶。
反应中Simmons-Smith试剂可以提前制取,也可以在反应中原位生成而参加反应。与格氏试剂的Schlenk平衡类似,Simmons-Smith试剂也存在如下平衡:
应用
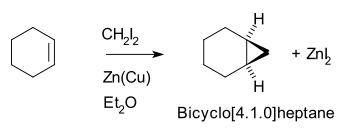
环己烯与二碘甲烷在锌铜偶的作用下,经过ICH2ZnI这一中间体(类卡宾),可以生成降蒈烷(二环[4.1.0]庚烷)[4][5]
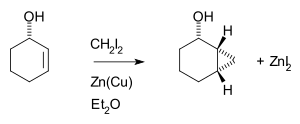
Simmons–Smith反应是立体专一的顺式加成。通常受位阻效应的影响,反应在双键位阻较小的一侧发生。[6][7] 但是,当双键上连有一个手性碳,该手性碳上又连有羟基取代基时,由于羟基可以与锌配位,反应往往在羟基的同侧发生,尽管这时的空阻可能较大:[8]
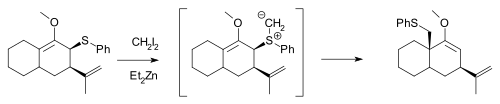
Simmons-Smith试剂可以和烯丙基硫醚反应生成硫叶立德。产物可以发生2,3-σ迁移反应,得不到环丙烷环系。(试剂过量时,可以进一步反应生成环丙烷环系)[9]
不对称Simmons-Smith反应
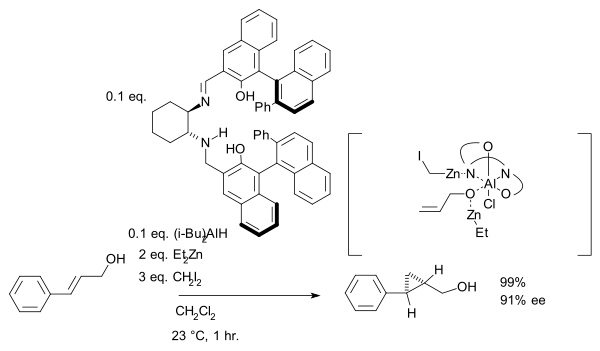
尽管基于重氮化合物的环丙烷环系的不对称合成法早在1966年就已经出现(参见双噁唑啉配体),不对称Simmons–Smith反应却在1992年才得到首次应用。[10] 在该反应中,肉桂醇与二乙基锌,二碘甲烷和一个手性的二磺酰胺在二氯甲烷中按照下式进行反应:
其中,羟基的存在是锚定锌(决定立体选择性)的前提条件。在另一个十分相似的反应中,用salen作配体,并且加入了路易斯酸DIBAL,如下式所示:[11]
参考文献
- Howard Ensign Simmons, Jr.; Smith, R.D. . J. Am. Chem. Soc. 1958, 80: 532. doi:10.1021/ja01548a031..
- Simmons, H.E.; Smith, R.D. . J. Am. Chem. Soc. 1959, 81: 4256. doi:10.1021/ja01525a036.
- Denis, J.M.; Girard, J.M.; Conia, J.M. . Synthesis. 1972, 1972: 549. doi:10.1055/s-1972-21919.
- Smith, R. D.; Simmons, H. E.. "Norcarane". Org. Synth.; Coll. Vol. 5: 855.
- Ito, Y.; Fujii, S.; Nakatuska, M.; Kawamoto, F.; Saegusa, T. (1988). "One-Carbon Ring Expansion Of Cycloalkanones To Conjugated Cycloalkenones: 2-Cyclohepten-1-one". Org. Synth.; Coll. Vol. 6: 327.
- Simmons, H. E.; et al. Org. React. (Review). 1973, 20: 1. 缺少或
|title=为空 (帮助) - Girard, C.; Conia, J. M. J. Chem. Res. (S) (Review). 1978: 182. 缺少或
|title=为空 (帮助) - Paul A. Grieco, Tomei Oguri, Chia-Lin J. Wang, and Eric Williams. . J. Org. Chem. 1977, 42: 4113. doi:10.1021/jo00445a027.
- Cohen, T.; Kosarych, Z. . J. Org. Chem. 1982, 47: 4005. doi:10.1021/jo00141a047.
- Hideyo Takahashi, Masato Yoshioka, Masaji Ohno and Susumu Kobayashi. . Tetrahedron Letters. 1992, 33 (18): 2575–2578. doi:10.1016/S0040-4039(00)92246-9.
- Hiroaki Shitama and Tsutomu Katsuki. . Angew. Chem. Int. Ed. 2008, 47: 2450. doi:10.1002/anie.200705641.