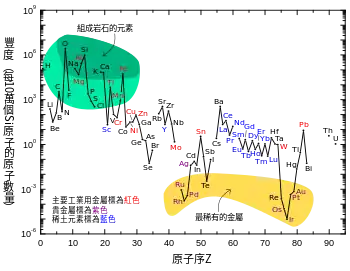
惰性金屬
貴金屬(英語:),又称惰性金属,是一類活性較低,室溫下抗氧化和耐腐蚀能力极强的金属,在自然界中通常能以游離態穩定存在(稱自然金屬),且在地壳中含量稀少。一般認定的貴金屬包括金、銀和六個鉑族元素:釕、銠、鈀、鋨、銥和鉑,其中金、銀、鉑、鈀又被稱為貴重金屬(英語:,中文亦常譯作貴金屬),在國際上被認可為期貨、期權及ETF的交易資產,各有其專屬的ISO 4217貨幣代碼。此外,有些學者把錸、銅和汞等也算作貴金属的一員。另一方面,並非所有耐腐蝕金屬都被認為是貴金屬。例如鈦、鋯、鉿、鈮和鉭等雖然都具有極佳的耐腐蝕能力,但它們並未被歸類為貴金屬。[1]
貴金属不和常見的酸起反应,但有些貴金属如鈀、銀、鉑、金等会溶于王水。按標準電極電勢排列,貴金属排列靠前,說明抵抗腐蚀能力较强。从原子结构來看,貴金属原子的外层电子数基本饱和,所以不易和其他元素化合,但铂有d軌域电子层跨越费米能级,因此会有不稳定的化学反应,可以作为催化剂使用。用超真空清洗貴金属会发现很容易清洗干净,并能长期保持清洁,但例如铂清洗后会立即吸附一层一氧化碳。
定義
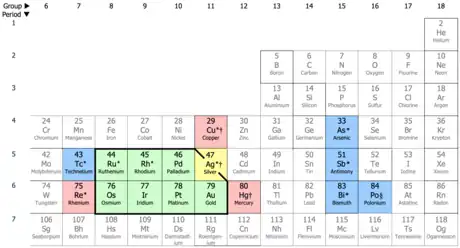
元素週期表中貴金屬元素的位置:
7 總是被視為貴金屬:釕(Ru)、銠(Rh)、鈀(Pd)、鋨(Os)、銥(Ir)、鉑(Pt)、金(Au)[2]
1 通常被當作貴金屬:銀(Ag)[3]
3 有時被歸為貴金屬:錸(Re)、銅(Cu)、汞(Hg)[4]
5 在某些條件下符合貴金屬的定義:鎝(Tc)、砷(As)、銻(Sb)、鉍(Bi)、釙(Po)
「貴金屬」最普遍的定義範疇即是表中黑框內的八個元素,其中銀由於反應性相對較高而有時不被認為是貴金屬。[5]
註:
標有*的元素表示其可能會在潮濕空氣中失去光澤或被含氧和氧化劑的酸性溶液腐蝕
標有†的元素表示其會被硫或硫化氫腐蝕
標有§的元素表示其會被自身釋放的游離輻射產生的臭氧所腐蝕
雖然不同文獻中所定義的貴金屬種類可能不盡相同,但往往包括金和六種鉑族金屬(釕、銠、鈀、鋨、銥、鉑)[2],而其他候選元素在週期表中也大多處在與標準貴金屬鄰近的位置。由於銀、銅和汞的化學活潑性較低,而錸在地殼中的稀有程度和黃金及鉑族金屬相當,故它們有時亦被列為貴金屬[4],但它們在自然界中大多以與硫等元素結合的化合態存在,而較少以游離態的單質存在,且銅在地殼中的豐度頗高。
在個別的學術及產業領域中,被視為貴金屬的元素數量可能更少或更多。在物理學中,“noble metal”一詞通常僅專指11族的銅、銀和金三個元素[6][7],因為它們的原子的d軌域全滿而較為「惰性」,而其他貴金屬(尤其是鉑族金屬)則因d軌域非全滿而具有顯著的催化性能。在牙科領域,銀通常不被視為貴金屬,因為它在口腔環境中會被腐蝕。[8]在化學中,noble metal一詞有時更廣泛地被用於指稱任何不與弱酸反應並釋放氫氣的金屬或類金屬元素,此時其定義範圍將擴大至鎝、錸、銅、汞、砷、銻、鉍和釙,以及前述的金、銀和鉑族金屬,儘管屬於類金屬的砷、銻和具有放射性的鎝、釙極少被視為貴金屬。
科學家根據計算出的屬性預測原子序介於108(𨭆)至116(鉝)的超重元素可能具有一些非常「貴金屬性」的特質。當前的實驗結果已證明𨭆表現出的化學性質與其較輕的同族元素鋨相似,而在針對鎶和鈇的初步化學實驗中它們也表現出部分較為惰性的化學性質,其中鎶的一些屬性似乎類似於其較輕同族元素汞。[9][10]然而,由於這些人造元素放射性極強、原子核極為不穩定,它們幾乎從來都不被納入貴金屬的範疇中。
 釕條
釕條 銠粉末、銠圓柱和銠珠
銠粉末、銠圓柱和銠珠.jpg.webp) 鈀晶體
鈀晶體 螺狀硫銀礦,主成分為硫化銀(Ag2S),為最重要的銀礦石
螺狀硫銀礦,主成分為硫化銀(Ag2S),為最重要的銀礦石.jpg.webp) 錸珠
錸珠 鋨晶體
鋨晶體 銥片
銥片 鉑晶體
鉑晶體_4_(16848647509).jpg.webp) 金塊
金塊
特性
地球化學性質
貴金屬中除銀之外皆為高度親鐵的元素[7],它們在地球形成之初大多以固溶體或熔融態的形式溶解在鐵中,並和鐵、鎳等沉入地核,因此在地殼中含量極端稀少,它們在含有大量鐵和鎳的流星體中的豐度反而相對較高(銥是最著名的例子)。[11]大多數親鐵元素對氧的親和性較低,其中金的氧化物甚至在熱力學上是不穩定的。
耐腐蝕性
和其他金屬元素相比,貴金屬單質的反應性較低,不易被多數酸或鹼侵蝕。而其他耐腐蝕金屬如鈦、鋯、鉿、鈮和鉭等大多是靠表面鈍化形成的緻密氧化膜來抵禦腐蝕,本身其實是相當活潑的金屬。
釕不溶於王水(濃鹽酸和濃硝酸的混合物)和其他酸,在無氧環境下也很耐鹼,但會和有氧化劑共存的鹼反應。銠不溶於硝酸等酸類,塊狀時不受王水侵蝕,一定要在細粉末狀態下,才能與王水發生反應。鈀是鉑族中最具化學活性的元素,可溶於熱濃硝酸、熱濃硫酸和含氧化劑的鹽酸等。銀不和高溫下的碱性氫氧化物反應,但可溶於硝酸和熱濃硫酸等。[7][12]
錸在反應性上缺乏貴金屬性質,雖然不受單一氫鹵酸侵蝕,但若和氧化劑共存則會迅速反應,錸也易溶於硝酸、雙氧水和溴水等。鋨在常溫下不易被王水等酸類侵蝕,但可溶於熱濃硫酸和熱濃硝酸。銥在環境條件下呈化學惰性,不被王水等酸類及氫氧化鹼侵蝕。[13]鉑不溶於單一酸,但易溶於王水和有氧化劑共存的鹽酸等。金不與單獨的氫鹵酸、硫酸、硝酸等酸反應,也不溶於無氧化劑共存的鹼,但可溶於王水和硒酸等。[7][14]
參考文獻
- Anne Marie Helmenstine, Ph.D. . ThoughtCo. 2019-12-02 [2023-04-26]. (原始内容存档于2023-03-15) (英语).
- Balcerzak, M. . . Wiley Online Library. 2021. doi:10.1002/9780470027318.a2411.pub3.
- Schlamp, G. . Warlimont, H; Martienssen, W (编). . Cham: Springer. 2018. doi:10.1007/978-3-319-69743-7_14.
- Kepp, KP. . ChemPhysChem. 2020, 21: 360–369. doi:10.1002/cphc.202000013.
- Rayner-Canham, G. . Scerri, E; Restrepo, G (编). . Oxford University. 2018: 195–205. ISBN 978-0-190-668532.
- Harrison WA 1989, Electronic structure and the properties of solids: The physics of the chemical bond, Dover Publications, p. 520
- 賴耿陽 (编). . 中華民國: 復漢出版社. 1992-04 [2023-09-09]. (原始内容存档于2023-09-08) (中文(臺灣)).
- Powers, JM; Wataha, JE. 10th. St Louis: Elsevier Health Sciences. 2013: 134. ISBN 9780323291507.
- Nagame, Yuichiro; Kratz, Jens Volker; Matthias, Schädel. . Nuclear Physics A. December 2015, 944: 614–639 [2023-04-26]. Bibcode:2015NuPhA.944..614N. doi:10.1016/j.nuclphysa.2015.07.013. (原始内容存档于2022-12-12).
- Mewes, J.-M.; Smits, O. R.; Kresse, G.; Schwerdtfeger, P. . Angewandte Chemie International Edition. 2019, 58 (50): 17964–17968. PMC 6916354
 . PMID 31596013. doi:10.1002/anie.201906966
. PMID 31596013. doi:10.1002/anie.201906966  .
. - Richard J. Walker (2014), "Siderophile element constraints on the origin of the Moon" (页面存档备份,存于), Philosophical Transactions of the Royal Society A, accessed 1 December 2015.
- W. Xing, M. Lee, Geosys. Eng. 20, 216, 2017
- Parish RV 1977, The metallic elements, Longman, London, p. 53, 115
- A. Holleman, N. Wiberg, "Inorganic Chemistry", Academic Press, 2001
- Shelef, M.; Graham, G. W. . Catalysis Reviews. 1994, 36 (3): 433–457. doi:10.1080/01614949408009468.
外部链接
- 费米能级数据库 (页面存档备份,存于)
- Hüger, E.; Osuch, K. . EPL (Europhysics Letters). 2005, 71: 276. doi:10.1209/epl/i2005-10075-5.