鹽基
鹽基或鹼基,有時也稱做鹼[1](儘管「鹼」具有多種意義)。這是根據布仑斯惕-劳里學說關於酸和鹽基的部份,鹽基可以簡單想像成吸收質子的物質。額外的定義包括提供孤立電子對(由吉爾伯特·路易斯提出),以及是氫氧根離子的來源(由阿伦尼乌斯提出)。這三種定義下,鹽基都是會和酸反應的物質,符合纪尧姆-弗朗索瓦·鲁埃勒在18世紀中提出的概念。
阿伦尼乌斯鹽基可以影響水的自電离化学平衡,讓氫離子的活性度比在純水中要低,因此,在標準狀態 下的pH值會大於7.0。可溶於水的鹽基若含有OH−,且會釋放相當量的OH−離子,即為碱。氧化物、氫氧化物、醇盐都是碱性,而弱酸的共軛酸鹼對也是較弱的鹽基。酸和鹽基的化學作用恰好相反,酸會增加水中的水合氢离子(H3O+)濃度,鹽基則會減少水合氢离子濃度。酸和鹽基在水溶液中的反應稱為中和反应,會產生水以及盐。若水溶液已經飽和,就會有盐類的沉淀。
鹽基的定義
法國化學家纪尧姆-弗朗索瓦·鲁埃勒於1754年製定了鹽基這一概念。他注意到當時的酸大多是揮發性液體(例如乙酸),與特定物質化合便會轉變為固態鹽。這些特定物質便是鹽的「根基」[2]並因此得名。鹼是鹽基的一個特殊例子,會在水溶液中釋出氫氧根離子。阿伦尼乌斯鹽基是指水溶而水溶液pH值經常大於7的鹽基。這些氫氧化物的水溶液也有一些共通的特性,觸感具黏滑和像肥皂的感覺,味道有苦味[3],也可以讓酸碱指示剂變色(例如讓紅色石蕊試紙變藍色)。阿瑞尼士鹽基(Arrhenius base)是氫氧根離子的來源。
- NaOH → Na+ + OH−
在更廣義的酸碱质子理论(1923年)中,布仑斯惕鹽基是可以接受氢正离子(H+,當時稱為質子)的物質。此定義包括了氫氧化物的水溶液,因為OH−會和H+反應,形成水,因此阿伦尼乌斯鹽基也屬於布仑斯惕鹽基,不過也有其他的不含氫氧根的布仑斯惕鹽基,例如氨(NH3)或是胺的水溶液[4],也會接受氢正离子,而且本身也會和水反應,增加水中氫氧根的濃度[5]。也有一些無機非水溶劑中包括布仑斯惕鹽基,會和溶劑化的質子反應,例如液氨中的NH2−就是鹽基離子,會接受NH4+的質子。布仑斯惕鹽基(Brønsted base)是指吸收質子的物質,下式中B−為鹽基:
- B + H+ → B+H
- B− + H+ → BH
吉爾伯特·路易斯明瞭水、氨和其他鹽基會和質子結合的原子是因為鹽基中有的孤電子對[5]。在酸碱电子理论中,路易斯鹽基是指可提供電子對的物質,可以提供一對電子給電子對接受者(路易斯酸)[6]。路易斯理論比布仑斯惕理論更通用。路易士鹽基(Lewis base)是孤立電子對的提供者,下式中B為鹽基:
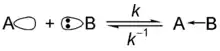
鹽基和pH值
量度(不純的)水的pH值,便是測試它的酸性。純水中,大約每千萬個水分子便有一個根據以下方程式電離為水合氫離子和氫氧根離子:
- 2H2O(l) → H3O+(aq) + OH−(aq)
濃度即是以摩爾濃度計算(M或摩爾每立方分米(mol/ dm3))水合氫離子和氫氧根離子的濃度;是為水的離解常數,數值為10−7 M。pH值定義為−log [H3O+];因此,純水的pH值是7。(這些數據均取於23 °C,並於不同溫度時有所差別。)
鹽基接收(或去除)溶液中的水合氫離子,或釋放氫氧根離子到溶液中。兩者均降低了水合氫離子在水中的濃度,從而提升pH值。相反,酸釋放水合氫離子或接收氫氧根離子而降低pH值。
例如,1莫耳的氫氧化鈉(40 克)溶於1公升的水中,氫氧根離子的濃度便是1摩爾每公升。所以氫離子濃度為每公升[H+] = 10−14 莫耳,而pH值 = −log 10−14 = 14.
鹼度係數(pKb)是鹼性的測量,並和酸度係數(pKa)有以下關係pKa + pKb = 14.
鹼濃度是量度溶液相對碳酸鹽或碳酸氫鹽中和酸的能力。
與酸的中和作用
當鹽基溶解於水中,氫氧化鈉离解為氫氧根離子和鈉離子:
- NaOH → Na+ + OH−
同樣地,氯化氫於水中生成水合氫離子和氯離子:
- HCl + H2O → H3O+ + Cl−
當兩種溶液混合,水合氫離子(H3O+)和氫氧根離子(OH−)化合生成水分子:
- H3O+ + OH− → 2 H2O
如果以相同份量的氫氧化鈉溶液和氫氯酸混合,鹽基和酸會恰好完全中和,於溶液中生成氯化鈉,即食鹽。
弱鹽基,如蘇打和蛋白,用於酸洩漏事件中的中和劑。以強鹽基如氫氧化鈉或氫氧化鉀中和會引起劇烈的放熱反應,同時鹽基也製造了和酸洩漏同等的破壞。
非金屬氧化物的鹼性
碳酸鈉和氨亦是鹽基,但它們都沒有氫氧根離子(OH−)。這是因為兩種都在溶解時接收氫離子(H+):
- Na2CO3 + H2O → 2 Na+ + HCO3− + OH−
- NH3 + H2O → NH4+ + OH−
鹽基的強弱
強鹽基是一種會完全水解的鹽基,並提升pH值到14或以上。強鹽基,像強酸一樣,會侵襲生物組織並引致灼傷。它們的反應不同,所以強酸具腐蝕性,而強鹽基則是苛性的。超強鹽基是一類特別的鹼性化合物而非親核鹼(暫無譯名)是一類缺少親核性的特殊強鹽基。而弱鹽基包括用於清潔的氨。
強鹽基
強鹽基是鹼性化合物所以能夠以酸鹼反應將弱鹽基去質子化。酸度係數大於及等於13的化合物都稱為強鹽基。常見例子包括鹼金屬和鹼土金屬的氫氧化物如氫氧化鈉及氫氧化鈣。非常強的鹽基甚至能在缺少水時將微酸性的烴去質子化。
以下是一些氫氧化物的強鹽基:
這些金屬的陽離子出現於元素週期表的第1和第2族上(即鹼金屬和鹼土金屬)。
第1族的碳陰離子,氨基以及氫化物鹽由於共軛酸而趨向成為更強的鹽基,能於烴、氨基和水中穩定。
- 正丁基鋰(n-BuLi)
- 二異丙基氨基鋰(LDA)(C6H14LiN)
- 氨基鈉(NaNH2)
- 氫化鈉(NaH)
路易士鹽基
酸碱电子理论中的路易士鹽基,也稱為電子對提供者,是有高能量電子對的分子,可以和有低能階空電子軌域的分子共享電子對,形成加成物。電子對接收者除了H+外,也包括一些中性分子(例如BF3)或金屬離子(例如Ag+或Fe3+)。包括金屬離子的加成物一般會用配合物來表示[7]。
依照吉爾伯特·路易斯原始的敘述,若中性的鹽基和中性的酸產生了鍵結,會有電子應力[8]。鹽基和酸會共享原來鹽基上的電子對[8],因此會產生很大的偶極矩,只有重組分子才能破壞偶極矩[8]。
鹽基作為異構催化劑
鹼性物質可用作化學反應的異構不可溶催化劑。例如氧化鎂,氧化鈣以及氧化鋇等金屬氧化物以及氧化鋁上的氟化鉀和某幾種沸石。大量過渡金屬化合物是良好催化劑,其中不少是鹼性的。鹼性催化劑可用於氫化、雙键的移動、米尔温–庞多夫–韦尔莱还原反应、迈克尔反應等反應。氧化鈣或氧化鎂若在高溫下都是高活性的催化劑[9]。
鹽基和鹼的混淆
鹽基(base)和鹼(alkali)這兩個術語交換使用,這是由於大部分的鹼都是鹽基。而金屬氧化物及金屬氫氧化物都是歸納為鹽基。「測量泥土中的鹼性」實際是量度pH值。
注意不是大部分碱金属鹽都是鹼,只有本身是鹼性的鹽才是鹼。
儘管大部分電陽的金屬氧化物都是鹼性,只有可溶的鹼金屬及鹼土金屬氧化物才可稱為鹼。
不可溶於水的例子
- 氧化銅等大部份金屬氧化物
註釋
- 大英百科全書線上繁體中文版
- The Origin of the Term Base William B. Jensen Journal of Chemical Education · 1130第83卷,2006年8月8日
- Johlubl, Matthew E. 2nd. New York: W. H. Freeman and Co. 2009. ISBN 978-1429209892. OCLC 392223218.
- Whitten et al. (2009),第363頁.
- Zumdahl & DeCoste (2013),第257頁.
- Whitten et al. (2009),第349頁.
- Miessler, Gary L.; Tarr, Donald A. 2nd. Prentice-Hall. 1999: 157–159. ISBN 0-13-841891-8.
- Lewis, Gilbert N. . Journal of the Franklin Institute. September 1938, 226 (3): 293–313 [3 September 2020]. doi:10.1016/S0016-0032(38)91691-6. (原始内容存档于2021-11-02).
- Tanabe, K.; Misono, M.; Ono, Y.; Hattori, H. . Elsevier. 1990: 14 [19 February 2015]. ISBN 9780080887555. (原始内容存档于2021-09-29).
- . [2006-08-03]. (原始内容存档于2006-09-13).
- . [2006-08-03]. (原始内容存档于2009-03-05).
- . [2006-05-23]. (原始内容存档于2006-05-23).
- . [2007-03-11]. (原始内容存档于2006-08-31).
- . [2006-08-03]. (原始内容存档于2006-08-13).
