石墨
石墨(Graphite),又稱黑鉛(Black Lead),是碳的一種同素異形體(碳的其他同素異形體有很多,為人熟悉的例如鑽石)。作为最軟的礦物之一,石墨不透明且觸感油膩,顏色由鐵黑到鋼鐵灰不等,形狀可呈晶體狀、薄片狀、鱗狀、條紋狀、層狀體,或散佈在變質岩(由煤、碳質岩石或碳質沉積物,受到區域變質作用或是岩漿侵入作用形成)之中[1]。化學性質不活潑,具有耐腐蝕性。
| 石墨 | |
|---|---|
 | |
| 基本資料 | |
| 類別 | 自然元素礦物 |
| 化学式 | C |
| 施特龙茨分类 | 01.CB.05a |
| 晶体空间群 | 复六方双锥晶族 赫尔曼–莫甘记号:(6/m 2/m 2/m) 空间群:P 63/mmc |
| 晶胞 | a = 2.461 Å,c = 6.708 Å;Z = 4 |
| 性質 | |
| 分子量 | 12.01 |
| 顏色 | 灰至黑色 |
| 晶体惯态 | 板狀、六方薄板狀、粒狀 |
| 晶系 | 六方晶系、三方晶系 |
| 解理 | {0001} 完全解理 |
| 断口 | 參差狀 |
| 韌性/脆性 | 具彎性 |
| 莫氏硬度 | 1 - 2 |
| 光澤 | 金屬或土狀光澤 |
| 條痕 | 光亮的黑色 |
| 透明性 | 不透明 |
| 密度 | 2.09-2.23g/cm³ |
| 折射率 | 不透明體 |
| 多色性 | 無 |
| 其他特徵 | 耐強酸鹼、耐火、良好導電性與導熱性 |
结构

(双层)石墨的旋转视图。
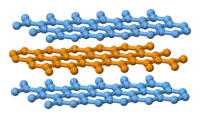
石墨層狀結構側視圖。
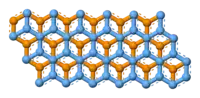
石墨層狀結構上視圖
石墨具有层状的平面结构,结构如左图所示。每层中碳原子都排列成蜂窝状晶体结构,层内原子间距0.142nm,层间距0.335nm。层内每個碳原子的週邊以共价键連結著另外三個碳原子,排列方式呈蜂巢式的多個六邊形,每層間有微弱的范德華力。由於每個碳原子均會放出一個電子,那些電子能夠自由移動,因此石墨屬於導電體。
用途

由於石墨的疊層結構易剝落,可於紙上書寫。
它的用途包括製造鉛筆筆芯和潤滑劑或集電弓上的碳刷條,也可作為壓力管式石墨慢化沸水反應爐的中子減速劑。
目前主要用途是耐火材料的原材料,尤其是镁碳砖。自然界自然形成的石墨可分为鳞片石墨和土状石墨。
因晶体结构中存在大量离域电子,石墨可以导电,其与晶体层平行的方向电阻率为(2.5~5.0)×10-6Ω·m,与层垂直的方向电阻率为3×10-3Ω·m。[2]
電解中的惰性電極可以由鉑製作,但由於會受鹵素侵蝕,所以在會產生鹵素(例如:電解食鹽鹽水)的電解時使用石墨替代鉑,作為惰性電極。
存在形式
碳的存在形式是多种多样的,有晶态单质碳如金刚石俗稱鑽石、石墨;有无定形碳如煤;有复杂的有机化合物如动植物等;碳酸盐如大理石等。单质碳的物理和化学性质取决于它的晶体结构。高硬度的金刚石(鑽石)和柔软滑腻的石墨晶体结构不同,各有各的外观、密度、熔点等。
參考
- . 藝術與建築索引典. [2010-11-04]. (原始内容存档于2011-12-17).
- Hugh O. Pierson, Handbook of carbon, graphite, diamond, and fullerenes: properties, processing, and applications, p. 61, William Andrew, 1993 ISBN 0-8155-1339-9.
外部連結
- (英文) 石墨 - Webmineral (页面存档备份,存于)
- (英文) 石墨 - Mindat (页面存档备份,存于)
- (英文) 電池級石墨
- (英文) Graphite at Minerals.net (页面存档备份,存于)
- (英文) Mineral galleries
- (英文) Mineral & Exploration – 2012年石墨礦和生產者的世界地圖
- (英文) Mindat w/ locations (页面存档备份,存于)
- (英文) giant covalent structures (页面存档备份,存于)
- (英文) The Graphite Page (页面存档备份,存于)
- (英文) Video lecture on the properties of graphite by Prof. M. Heggie (页面存档备份,存于), University of Sussex
- (英文) CDC – NIOSH Pocket Guide to Chemical Hazards (页面存档备份,存于)
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
