乙硫醇
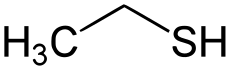
乙硫醇(分子式:CH3CH2SH),常见硫醇之一,结构上由乙醇中的氧原子被硫替代得到。无色透明易挥发的高毒油状液体,微溶于水,易溶于碱液和有机溶剂中,以具有强烈、持久且具刺激性的蒜臭味而闻名。它是2000年版吉尼斯世界纪录中收录的最臭的物质。空气中仅含五百亿分之一的乙硫醇时(0.00019mg/L),其臭味就可嗅到。
| 乙硫醇[1] | |||
|---|---|---|---|
 | |||
| |||
| IUPAC名 Ethanethiol | |||
| 别名 | 巯基乙烷 | ||
| 识别 | |||
| CAS号 | 75-08-1 | ||
| SMILES |
| ||
| RTECS | KI9625000 | ||
| 性质 | |||
| 化学式 | C2H5SH | ||
| 62.13404 g·mol⁻¹ | |||
| 外观 | 无色透明油状液体 | ||
| 密度 | 0.8617 g/cm3 | ||
| 熔点 | -148 °C | ||
| 沸点 | 35 °C | ||
| 溶解性(水) | 6.76 g/L (25°C) | ||
| 危险性 | |||
| 警示术语 | R:R11, R20, R50/53 | ||
| 安全术语 | S:S16, S25, S60, S61 | ||
| 主要危害 | 腐臭气味 | ||
| 闪点 | -17 °C | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
制备
制备方法有:
参考资料
- Merck Index, 12th edition, 3771
- Mirrington, R. N.; Feutrill, G. I. (1988). "Orcinol Monomethyl Ether". Org. Synth.; Coll. Vol. 6: 859.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.