二氧化钚
二氧化鈈是鈈最稳定的氧化物,化學式為PuO2。它的顏色可以從黃色变化到橄欖綠色,取決於粒子的大小、溫度和生產方式。[3]
| 二氧化钚 | |
|---|---|
 | |
 | |
| IUPAC名 Plutonium(IV) oxide | |
| 系统名 Plutonium(4+) oxide | |
| 别名 | 氧化钚(IV) |
| 识别 | |
| CAS号 | 12059-95-9 |
| ChemSpider | 10617028 |
| SMILES |
|
| 性质 | |
| 化学式 | O2Pu |
| 摩尔质量 | 276 g·mol−1 |
| 外观 | 棕黃色結晶[1] |
| 密度 | 11.5 g cm-3[1] |
| 熔点 | 2400 °C(2673 K)([1]) |
| 沸点 | 2800 °C(3073 K) |
| 溶解性 | 难溶于酸[2] |
| 结构 | |
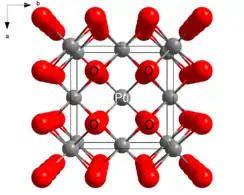
| 晶体结构 | 螢石(立方晶系),cF12 |
| 空间群 | Fm3m (No. 225 ) |
| 配位几何 | 四面体(O2–);正方体(Pu4+) |
| 危险性 | |
| 主要危害 | 放射性 |
| NFPA 704 |
 0
4
0
|
| 闪点 | 不可燃 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
危害
二氧化钚在体内的行为因进入人体的方式而异。摄入二氧化钚后,大部分会以废物的形式迅速排出体外,[7]但有一小部分会在胃酸中离解成离子并穿过血液屏障,留在其它器官里。[8]由于其强放射性,二氧化钚有剧毒。[9]
参考资料
- Lide, David R. (编). 90th. Boca Raton, Florida: CRC Press. 2009: 81. ISBN 978-1-4200-9084-0 (英语).
- Baudler, Marianne. . Stuttgart. 1978: 1305. ISBN 978-3-432-87813-3. OCLC 310719490 (德语).
- . Los Alamos Laboratory. [2022-08-06]. (原始内容存档于2010-05-27). (页面存档备份,存于)
- Greenwood, Norman N.; Earnshaw, A. . Oxford: Pergamon. 1984: 1471. ISBN 0-08-022057-6.
- Tilmann Althaus: „Cassini und die Nuklearenergie“, in: Sterne und Weltraum, 1998, 37 (3), S. 220–223.
- Environmental Effects of Plutonium Dioxide,存档于saturn.jpl.nasa.gov 错误:存档服务未知(存檔日期 2006-09-29) (PDF; 30 kB).
- United States Nuclear Regulatory Commission, Fact sheet on plutonium (页面存档备份,存于) (accessed Nov 29 2013)
- Gwaltney-Brant, Sharon M., Haschek, Wanda M.; Rousseaux, Colin G.; Wallig, Matthew A. , 编, , Haschek and Rousseaux's Handbook of Toxicologic Pathology (Third Edition) (Boston: Academic Press), 2013-01-01: 1315–1347 [2022-04-10], ISBN 978-0-12-415759-0, (原始内容存档于2022-04-10) (英语)
- (PDF). U.S. Department of Health and Human Services. 2007-09-27 [2009-04-23]. (原始内容存档 (PDF)于2012-05-28). (页面存档备份,存于)
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.