二溴氧化硒
| 二溴氧化硒 | |
|---|---|
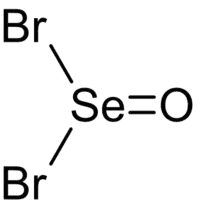 | |
| 别名 | 溴氧化硒 |
| 识别 | |
| CAS号 | 7789-51-7 |
| PubChem | 82242 |
| ChemSpider | 74220 |
| SMILES |
|
| InChI |
|
| InChIKey | ZWTYAOCEBBZVQQ-UHFFFAOYAF |
| 性质 | |
| 化学式 | SeOBr2 |
| 254.77 g/mol g·mol⁻¹ | |
| 外观 | 红黄色固体 |
| 密度 | 3.38 g/cm3,固态 |
| 熔点 | 41.6 °C(315 K) |
| 沸点 | 220 °C(493 K)(分解) |
| 溶解性(水) | 反应 |
| 溶解性 | 可溶于二硫化碳、苯和四氯化碳[1] |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
制备
二溴氧化硒可以由二氧化硒 和四溴化硒反应而成。 硒和二氧化硒会和溴 反应,形成一溴化硒和四溴化硒。 二氧化硒和四溴化硒的反应会产生二溴氧化硒。[2]
- 2 Se + Br2 → Se2Br2
- Se2Br2 + 3 Br2 → SeBr4
- SeBr4 + SeO2 → 2 SeOBr2
性质
二溴氧化硒,是一种红棕色固体具有低熔点 (41.6 °C) ,化学性质类似二氯氧化硒。 它在 220 °C 下沸腾并分解,使得分馏不是一种分离二溴氧化硒的好方法。 它的 电导率(液态,稍高于熔点)是 6×10−5 S/m。 SeOBr2 会水解 ,形成H2SeO3 和 HBr。
SeOBr2 的反应性很高,大部分反应都在液态下进行。 它会分解成 Se2Br2。 铁、铜、金、铂和锌都会被 SeOBr2反应。[2]
参考资料
- Lide, David R. 87. Boca Raton, Florida: CRC Press. 1998: 4–81. ISBN 0-8493-0594-2.
- Lenher, Victor. . Journal of the American Chemical Society. 1 August 1922, 44 (8): 1668–1673 [2020-11-11]. doi:10.1021/ja01429a008. (原始内容存档于2021-01-06).
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.