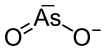亚砷酸钾
亚砷酸钾(KAsO2)是一种无机化合物,以两种形式存在,分别为偏亚砷酸钾(KAsO2)和原亚砷酸钾(K3AsO3)。它含有亚砷酸根离子(AsO33-或AsO2 -),砷总是以+3氧化态存在,钾以+1氧化态存在。[3] 与许多其他含砷化合物一样,亚砷酸钾对人体具有毒性和致癌性。亚砷酸钾是福勒溶液的基本成分,该溶液历史上被用作药用补品,但由于其毒性,其已经停止使用。[4][5] 但亚砷酸钾仍被用作杀鼠剂。[6]
| 亚砷酸钾 | ||
|---|---|---|
| ||
| 识别 | ||
| CAS号 | 10124-50-2 | |
| PubChem | 61616 | |
| SMILES |
| |
| 性质 | ||
| 化学式 | KAsO2 | |
| 146.019 g·mol⁻¹ | ||
| 外观 | 白色易潮解粉末 | |
| 密度 | 8.76 g/cm3 | |
| 熔点 | 300 °C(573 K)(分解) | |
| 危险性 | ||
| PEL | [1910.1018] TWA 0.010 mg/m3[1] | |
| 致死量或浓度: | ||
LD50(中位剂量) |
14 mg/kg (oral, rat)[2] | |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | ||
结构
两种不同形式的亚砷酸钾可归因于不同数量的氧原子。偏亚砷酸钾(KAsO2 )含有两个氧原子,其中一个通过双键与砷原子键合。与此不同,原亚砷酸钾(K3AsO3)由三个氧原子组成,所有三个氧原子都通过单键与砷原子结合。在这些情况中的每一种中,砷都以+3氧化态存在并且被称为亚砷酸盐,因此这单个名称指的是两种不同的结构。[3]此外,亚砷酸钾的两种形式具有相同的性质。
性质
亚砷酸钾是一种无机盐,以无味的白色固体形式存在。它易溶于水,微溶于乙醇。亚砷酸钾溶液含有中等浓度的氢氧根,因此略呈碱性。[7] 虽然亚砷酸钾是不可燃的,但加热会导致其分解并形成包括砷化氢、砷氧化物和氧化钾在内的有毒烟雾。亚砷酸钾也可与酸反应生成有毒的砷化氢气体。[6]
制备
亚砷酸钾水溶液,通常称为福勒溶液,可以通过在水存在下用氢氧化钾(KOH)加热三氧化二砷(As2O3 )来制备。[8][9] 反应如下所示
- As2O3 (aq) + 2 KOH (aq) → 2 KAsO2 (aq) + H2O
用途
在十八世纪,英国医生托马斯·福勒(1736-1801)[10]利用一种名为福勒溶液的亚砷酸钾溶液来治疗许多疾病,包括贫血、风湿病、牛皮癣、湿疹、皮炎、哮喘、霍乱和梅毒。1865年,亚砷酸钾作为福勒溶液被用作治疗白血病的第一种化疗药物,但化疗效果只是暂时的。令人惊讶的是,这种特殊用途的灵感来自于亚砷酸钾在改善消化和让马产生更光滑外皮的作用。[4] 亚砷酸钾也是某些杀鼠剂、杀虫剂和除草剂的关键无机成分。此外,它作为杀虫剂的作用也使它成为一种很好的木材防腐剂;然而,溶解度和毒性使其成为环境的潜在风险因素。[7]
健康影响
亚砷酸钾的毒性来自砷对巯基的强亲和力。这些亚砷酸盐-硫键的形成损害了某些酶的功能,例如谷胱甘肽还原酶、谷胱甘肽过氧化物酶、硫氧还蛋白还原酶和硫氧还蛋白过氧化物酶。这些酶都与自由基的防御和丙酮酸的代谢密切相关。因此,暴露于亚砷酸钾和其他含亚砷酸盐的化合物将导致产生破坏性的氧自由基和细胞代谢停滞。[11]
此外,含亚砷酸盐的化合物也被标记为致癌物质。亚砷酸钾的致癌性源于其抑制DNA修复和甲基化的能力。这种细胞机制的损伤可导致癌症,因为细胞不再能够修复或阻止突变并导致肿瘤。[12] 所有这些条件都表现出亚砷酸钾和其他含亚砷酸盐化合物的危险性。大鼠的LD50为14 mg/kg,人类的TDL为74 mg/kg。[13]
注释
- . 美国国家职业安全卫生研究所. [2019-05-25]. (原始内容存档于2017-05-11).
- . [2019-05-25]. (原始内容存档于2014-12-09).
- Lide, D. R. . 1993. ISBN 0-8493-0474-1.
- Jolliffe, D. M. . Journal of the Royal Society of Medicine. 1993, 86 (5): 287–289. PMC 1294007
 . PMID 8505753.
. PMID 8505753. - Lander J.J.; Stanley R.J.; Sumner H.W.; Boswell D.C.; Aach R.D. . Gastroenterology. 1975, 68 (6): 1582–1586. PMID 1169181.
- Potassium Arsenite. http://nj.gov/health/eoh/rtkweb/documents/fs/1557.pdf (页面存档备份,存于)
- U.S. Dept. of Health and Human Services, Public Health Service. (PDF). Report on Carcinogens, Thirteenth Edition. October 2, 2014 [2019-05-25]. (原始内容存档 (PDF)于2019-06-28).
- Caspari, Charles. 2nd. Philadelphia: Lea Brothers and Co. 1901.
- Tinwell, H.; Stephens, S. C.; Ashby, J. (PDF). Environmental Health Perspectives. 1991, 95: 205–210 [2019-05-25]. PMC 1568403
 . PMID 1821373. doi:10.2307/3431125. (原始内容 (PDF)存档于2022-04-15).
. PMID 1821373. doi:10.2307/3431125. (原始内容 (PDF)存档于2022-04-15). - Doyle, Derek. . British Journal of Haematology. 2009, 145 (3): 309–317. doi:10.1111/j.1365-2141.2009.07623.x.
- Chen, Sai-Juan; Zhou, Guang-Biao; Zhang, Xiao-Wei; Mao, Jian-Hua; The ́, Hugues de; Chen, Zhu. (PDF). Blood. 16 June 2011, 117 (24).
- Xiong, Lei; Wang, Yinsheng. . Journal of Proteome Research. 5 February 2010, 9 (2): 1129–1137. PMC 2819029
 . PMID 20050688. doi:10.1021/pr9011359.
. PMID 20050688. doi:10.1021/pr9011359. - . TOXNET: Toxicology Data Network. [6 December 2014]. (原始内容存档于2014-12-09).