四氟化硫
四氟化硫是一种硫的氟化物,化學式為SF4。在標準環境下為無色具腐蝕性以及劇毒氣體,接觸水或潮濕環境會产生危險的氢氟酸。儘管如此,四氟化硫仍用於有機合成,是製作有机氟化合物的常用試劑。[3]
| 四氟化硫 | |||
|---|---|---|---|
 | |||
| |||
| IUPAC名 Sulfur(IV) fluoride | |||
| 识别 | |||
| CAS号 | 7783-60-0 | ||
| PubChem | 24555 | ||
| ChemSpider | 22961 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | QHMQWEPBXSHHLH-UHFFFAOYAT | ||
| UN编号 | 2418 | ||
| ChEBI | 30495 | ||
| RTECS | WT4800000 | ||
| 性质 | |||
| 化学式 | SF4 | ||
| 108.07 g·mol⁻¹ | |||
| 外观 | 無色氣體 | ||
| 密度 | 1.95 g/cm3, −78 °C | ||
| 熔点 | −121.0 °C | ||
| 沸点 | −38 °C | ||
| 溶解性(水) | 分解 | ||
| 蒸氣壓 | 10.5 atm (22°C)[1] | ||
| 结构 | |||
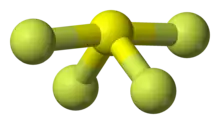
| 分子构型 | 蹺蹺板型 | ||
| 偶极矩 | 0.632 德拜[2] | ||
| 危险性 | |||
| MSDS | ICSC 1456 | ||
| 欧盟编号 | 未列出 | ||
| 主要危害 | 剧毒 腐蝕性 | ||
| NFPA 704 |
 0
3
2
COR
| ||
| PEL | none[1] | ||
| 相关物质 | |||
| 其他阴离子 | 二氯化硫 二溴化二硫 三氟化硫 | ||
| 其他阳离子 | 二氟化氧 四氟化硒 四氟化碲 四氟化釙 | ||
| 相关化合物 | 二氟化二硫 二氟化硫 六氟化硫 | ||
| 相关化学品 | 亞硫酰氟 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
結構
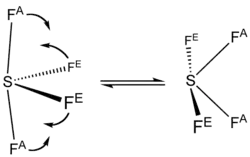
四氟化硫中的硫為+4氧化态。硫有六粒價電子,其中兩粒形成孤電子對。四氟化硫的形狀可由VSEPR理論預計而知為蹺蹺板型,其中硫在分子的中心。三个赤道位置之一被没有成键的孤对电子占据。因此,该分子具有两种不同类型的氟原子,两个在轴向位置,另外两个在赤道位置。四氟化硫中的S–Fax键长为164.3 pm,S–Feq键长为154.2 pm。超价分子中的轴向原子通常键合较弱。相较于SF4,相关的SF6的硫在+6氧化态,没有未键合的价电子,使得这个分子有非常对称的八面体结构。此外和SF4相反,SF6极端惰性。
SF4的19F NMR光谱只有一个信号,这表明轴向和赤道的氟原子位置通过假旋转快速相互转换。[4]
合成和製造
- SCl2 + Cl2 + 4 NaF → SF4 + 4 NaCl
- 3 SCl2 + 4 NaF → SF4 + S2Cl2 + 4 NaCl
SF4 也可以在没有溶剂的情况下在高温下生产的。[6][7]
此外, SF4 可以由S、NaF和Cl2在高温下(225–450 °C)反应而成。[6][7]
在较低温度下 (20–86 °C) 高产率合成 SF4 的方法有用Br2代替Cl2、S 和KF反应而成:[8]
- S + (2 + x) Br2 + 4 KF → SF4↑ + x Br2 + 4 KBr
用于合成有机氟化合物
在有机合成中,SF4可以把COH和C=O基团分别氟化成CF和CF2。[9]某些醇可以被四氟化硫氟化成一氟化物,而酮和醛会被氟化成偕二氟化物。羰基α质子的存在会导致副反应并降低产率至30-40%。二醇和四氟化硫的反应会产生环状的亚硫酸酯 (RO)2SO。羧酸和四氟化硫反应,可以得到三氟甲基化合物。举个例子,庚酸和SF4在100–130 °C下反应,会产生1,1,1-三氟庚烷。类似的,六氟丁炔可以从丁炔二酸开始合成。反应的副产物包括未反应的SF4、SOF2和SO2,这些有毒物质可以被氢氧化钾中和。
近年来,SF4的使用正在被更方便处理的二乙氨基三氟化硫 (CH3CH2)2NSF3所取代。[10]这种试剂是从SF4开始合成的:[11]
- SF4 + Me3SiNEt2 → Et2NSF3 + Me3SiF
外部連結
- NIOSH Pocket Guide to Chemical Hazards. . NIOSH.
- Tolles, W. M.; W. M. Gwinn, W. D. . J. Chem. Phys. 1962, 36: 1119–1121. doi:10.1063/1.1732702.
- Wang, C.-L. J. . Paquette, L. (编). . New York: J. Wiley & Sons. 2004. doi:10.1002/047084289X. hdl:10261/236866
 .
. - Holleman, A. F.; Wiberg, E. . San Diego: Academic Press. 2001. ISBN 0-12-352651-5.
- Fawcett, F. S.; Tullock, C. W. . Inorganic Syntheses. 1963, 7: 119–124. doi:10.1002/9780470132388.ch33.
- Tullock, C. W.; Fawcett, F. S.; Smith, W. C.; Coffman, D. D. . J. Am. Chem. Soc. 1960, 82 (3): 539–542. doi:10.1021/ja01488a011.
- US 2992073,Tullock, C.W.,「Synthesis of Sulfur Tetrafluoride」,发行于1961
- Winter, R.W.; Cook P.W. (2010). "A simplified and efficient bromine-facilitated SF4-preparation method". J. Fluorine Chem. 131: 780-783. doi:10.1016/j.jfluchem.2010.03.016
- Hasek, W. R.. "1,1,1-Trifluoroheptane". Org. Synth.; Coll. Vol. 5: 1082.
- Fauq, A. H. . Paquette, L. (编). . New York: J. Wiley & Sons. 2004. doi:10.1002/047084289X. hdl:10261/236866
 ..
.. - W. J. Middleton. "Diethylaminosulfur Trifluoride". Org. Synth.; Coll. Vol. 6: 440.
- Nyman, F.; Roberts, H. L.; Seaton, T. . Inorganic Syntheses (McGraw-Hill). 1966, 8: 160. doi:10.1002/9780470132395.ch42.
- Greenwood, Norman Neill; Earnshaw, Alan. . 2016. ISBN 978-0-7506-3365-9. OCLC 1040112384 (英语).
- Johnston, H. . World Scientific. 2003: 33–36. ISBN 981-238-153-8.