四氟化锗
四氟化锗是一种无机化合物,化学式为GeF4,它是无色气体。
| 四氟化锗 | |
|---|---|
 | |
| 别名 | 氟化锗 氟化锗(IV) |
| 识别 | |
| CAS号 | 7783-58-6 |
| PubChem | 82215 |
| ChemSpider | 11282354 |
| SMILES |
|
| EINECS | 232-011-3 |
| 性质 | |
| 化学式 | GeF4 |
| 148.634 g·mol⁻¹ | |
| 外观 | 无色气体 |
| 密度 | 6.074 g/L (气态) 2.46 g/mL(液态)[1] |
| 熔点 | −15 °C(258 K)(4 bar) |
| 沸点 | −36.5 °C(236.7 K)(升华) |
| 磁化率 | −50.0·10−6 cm3/mol |
| 结构 | |
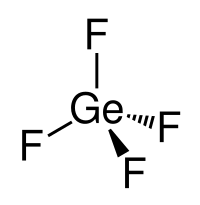
| 分子构型 | 四面体 |
| 热力学 | |
| ΔfHm⦵298K | -8.008 kJ/g |
| 危险性 | |
| 警示术语 | R:R26 R35 |
| 安全术语 | S:S9 S26 S28 S36 S45 |
| 主要危害 | 腐蚀性,和水反应生成HF |
| NFPA 704 |
 0
3
2
|
| 闪点 | 不可燃 |
| 相关物质 | |
| 其他阴离子 | 四氯化鍺 四溴化锗 四碘化锗 |
| 其他阳离子 | 四氟化碳 四氟化硅 四氟化锡 四氟化铅 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
制备
四氟化锗可由二氧化锗和氟化氢反应,或者锗和氟化氢或氟反应得到:
- Ge + 2 F2 → GeF4
配合物Ba[GeF6]的热分解反应也能制得四氟化锗:[2]
- Ba(GeF6) → GeF4 + BaF2
性质
四氟化锗是一种不可燃的发烟气体,有大蒜味。它和水反应,生成氟化氢和二氧化锗。它在1000 °C以上发生热分解反应。[3]它和粉末状的锗在150–300 °C反应,生成二氟化锗。[4]
GeF4和氟化物反应,生成GeF5−,这种阴离子因为聚合作用,Ge有着八面体的配位结构。[5]GeF5−的分离三角双锥结构由“裸氟”离子试剂1,3-二(2,6-二异丙基苯基)咪唑鎓氟化物的反应得到。[6]
参考文献
- Germanium(IV) fluoride (页面存档备份,存于). sigmaaldrich.com
- Georg Brauer: Handbuch der Präparativen Anorganischen Chemie
- Germaniumtetrafluorid (页面存档备份,存于). IFA Database
- Greenwood, N. N.; Earnshaw, A. . Butterworth Heinemann. 1998: 376–377. ISBN 0-7506-3365-4.
- Mallouk, T. E., Desbat, B., & Bartlett, N. (1984). Structural studies of salts of cis and trans .mu.-fluoro-bridged polymers of pentafluorogermanate(1-) and of the pentafluorogermanate(1-) monomer. Inorganic Chemistry, 23(20), 3160-3166. doi: 10.1021/ic00188a027
- Alič, B., Tramšek, M., Kokalj, A., & Tavčar, G. (2017). Discrete GeF5– Anion Structurally Characterized with a Readily Synthesized Imidazolium Based Naked Fluoride Reagent. Inorganic Chemistry, 56(16), 10070-10077. doi: 10.1021/acs.inorgchem.7b01606
拓展链接
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.