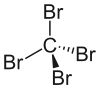
四溴化碳
| 四溴化碳 | |||
|---|---|---|---|
 | |||
| |||
 | |||
| IUPAC名 Tetrabromomethane[1] 四溴甲烷 | |||
| 识别 | |||
| 缩写 | R-10B4 | ||
| CAS号 | 558-13-4 | ||
| PubChem | 11205 | ||
| ChemSpider | 10732 | ||
| SMILES |
| ||
| Beilstein | 1732799 | ||
| Gmelin | 26450 | ||
| UN编号 | 2516 | ||
| EINECS | 209-189-6 | ||
| ChEBI | 47875 | ||
| RTECS | FG4725000 | ||
| MeSH | carbon+tetrabromide | ||
| 性质 | |||
| 化学式 | CBr4 | ||
| 摩尔质量 | 331.63 g·mol−1 | ||
| 外观 | 有甜味的无色晶体[2] | ||
| 密度 | 2.9608 g/cm3(100 °C)[2] | ||
| 熔点 | 90.1 °C(363 K)([2]) | ||
| 沸点 | 189.5 °C(463 K)([2]) | ||
| 溶解性(水) | 几乎不溶[2] | ||
| 溶解性 | 可溶于乙醚, 氯仿, 乙醇 | ||
| 蒸氣壓 | 5.33 kPa(96.3 °C) | ||
| 磁化率 | -93.73·10−6 cm3/mol | ||
| 折光度n D |
1.5942(100 °C)[3] | ||
| 结构 | |||
| 晶体结构 | 单斜 | ||
| 分子构型 | 四面体形 | ||
| 偶极矩 | 0 D | ||
| 热力学 | |||
| ΔfHm⦵298K | 26.0–32.8 kJ mol−1 | ||
| ΔcHm⦵ | −426.2–−419.6 kJ mol−1 | ||
| S⦵298K | 212.5 J/mol K | ||
| 热容 | 0.4399 J K−1 g−1 | ||
| 危险性 | |||
GHS危险性符号  | |||
| GHS提示词 | 危险 | ||
| H-术语 | H302, H315, H318, H335 | ||
| P-术语 | P261, P280, P305+351+338 | ||
| NFPA 704 |
 0
2
0
| ||
| 闪点 | 不可燃 | ||
| PEL | 无[4] | ||
| 致死量或浓度: | |||
LD50(中位剂量) |
| ||
| 相关物质 | |||
| 相关溴代烷 | |||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
物理性质
四溴化碳有两种晶型,在46.9°C以下的晶型II(或β)和在46.9°C之上的I(或α)。单晶有C2/c空间群,晶胞参数为a = 20.9, b = 12.1, c = 21.2 (.10−1 nm), β = 110.5°。[6]C-Br的键能为235 kJ.mol−1。(共價鍵)[7]
它的对称取代四面体结构使之偶极矩为0 Debye。它的临界温度为439 °C (712 K),临界压力为4.26 MPa。[6]
应用
四溴化碳可以用作油脂、蜡和油的溶剂,在塑料和橡胶工业中用于吹塑和硫化,以进一步用于聚合,它也可用作镇静剂和作为制造农业化学品的中间体。由于其不易燃,作为耐火化学品的成分。由于密度大,它也可用于矿物质的分离。
参考文献
- . PubChem Compound. USA: National Center for Biotechnology Information. Identification. 26 March 2005 [18 June 2012]. (原始内容存档于2013-11-03).
- Record of Tetrabrommethan in the GESTIS Substance Database from the IFA
- Lide, David R. (编). 90th. Boca Raton, Florida: CRC Press. 2009: 3–468. ISBN 978-1-4200-9084-0 (英语).
- NIOSH Pocket Guide to Chemical Hazards. . NIOSH.
- Greenwood, N. N.; Earnshaw, Alan. . Weinheim. 1990: 359. ISBN 978-3-527-26169-7. OCLC 46170372 (德语).
- F. Brezina, J. Mollin, R. Pastorek, Z. Sindelar. Chemicke tabulky anorganickych sloucenin (Chemical tables of inorganic compounds). SNTL, 1986.
- N. N. Greenwood, A. Earnshaw. Chemie prvku (Chemistry of the Elements). Informatorium, Prague, 1993.
拓展链接
- 国际化学品安全卡0474
- NIOSH Pocket Guide to Chemical Hazards. . NIOSH.
- MSDS at SIRI.org(页面存档备份,存于)
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.

