夏普莱斯不对称双羟基化反应
夏普莱斯不对称双羟基化反应(Sharpless asymmetric dihydroxylation),常直接称为不对称双羟基化反应(AD反应),是巴里·夏普莱斯在 Upjohn双羟基化反应的基础上,于1987年发现的以金鸡纳碱衍生物催化的烯烃不对称双羟基化反应。[1][2][3] 与夏普莱斯环氧化反应一样,该反应也是现代有机合成中最重要的反应之一。
典型的反应条件是以四氧化锇(OsO4)和二氢奎宁(DHQ)或二氢奎尼丁(DHQD)的手性配体衍生物作为催化剂,以计量的铁氰化钾[4][5]、N-甲基吗啉N-氧化物(NMO)[6][7] 或叔丁基过氧化氢作为再氧化剂,并加入其他添加剂如碳酸钾和甲磺酰胺等。现实条件中常用非挥发性的锇酸盐 K2OsO2(OH)4 代替 OsO4。[1][3] 市售的二羟化混合物试剂称为AD-mix,有 AD-mix α(含 (DHQ)2-PHAL)和 AD-mix β(含 (DHQD)2-PHAL)两种。[8]
大多数烯烃在上述条件下,能都以高产率、高ee值生成光学活性的邻二醇,而且反应条件温和,无需低温、无水、无氧等条件。[9] DHQ 和 DHQD 衍生物可分别用于一对对映异构邻二醇的合成,反应产物的立体构型可根据烯烃的结构,利用下图来进行预测。DHQ 和 DHQD 的各类衍生物都可用作催化剂的手性配体,但最有效的配体是酞嗪(2,3-二氮杂萘)衍生物 (DHQ)2-PHAL 和 (DHQD)2-PHAL。
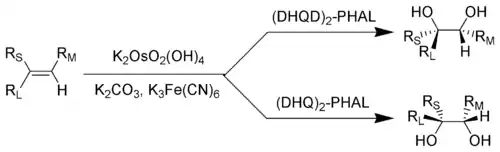
RL = 体积最大的取代基;RM = 体积中等的取代基;RS = 体积最小的取代基
反应机理
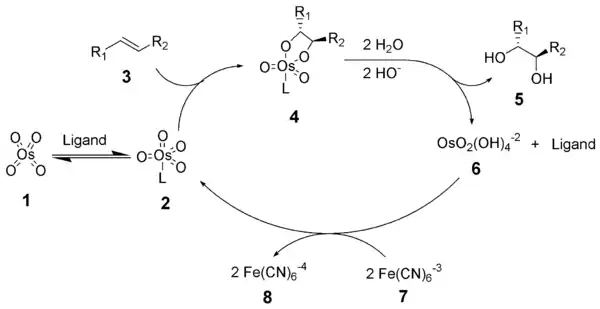
反应的催化循环如下。由锇酸钾原位生成的四氧化锇与配体结合为络合物 2,该络合物对烯烃发生对映选择性的 [3+2] 环加成反应(锇氧化反应)。[10][11] 生成的锇酸酯 4 经水解得到二醇和被还原的锇酸盐。后者被计量的再氧化剂氧化为四氧化锇而重复使用。
参见
- 不对称催化氧化反应
- Milas羟基化反应
- Upjohn双羟基化反应
- Sharpless不对称氨羟基化反应
- 化学反应列表
参考资料
- Jacobsen, E. N.; Marko, I.; Mungall, W. S.; Schroeder, G.; Sharpless, K. B. J. Am. Chem. Soc. 1988, 110, 1968. doi:10.1021/ja00214a053
- Kolb, H. C.; Van Nieuwenhze, M. S.; Sharpless, K. B. Chem. Rev. 1994, 94, 2483-2547. (综述)doi:10.1021/cr00032a009
- Gonzalez, J.; Aurigemma, C.; Truesdale, L. Org. Syn., Coll. Vol. 10, p.603 (2004); Vol. 79, p.93 (2002). 链接 (页面存档备份,存于)
- Minato, M.; Yamamoto, K.; Tsuji, J. J. Org. Chem. 1990, 55, 766-768. doi:10.1021/jo00289a066
- Oi, R.; Sharpless, K. B. Org. Syn., Coll. Vol. 9, p.251 (1998); Vol. 73, p.1 (1996). 链接 (页面存档备份,存于)
- VanRheenen, V.; Kelly, R. C.; Cha, D. Y. Tetrahedron Lett. 1976, 1973-1976.
- McKee, B. H.; Gilheany, D. G.; Sharpless, K. B. Org. Syn., Coll. Vol. 9, p.383 (1998); Vol. 70, p.47 (1992). 链接 (页面存档备份,存于)
- Sharpless, K. B., et al. J. Org. Chem. 1992, 57, 2768-2771. doi:10.1021/jo00036a003
- Kolb, H. C.; van Nieuwenhze, M. S.; Sharpless, K. B. Chem. Rev. 1994, 94, 2483-2547.(综述)doi:10.1021/cr00032a009
- Corey, E.J.; Noe, M. C.; Grogan, M. J. Tetrahedron Lett. 1996, 37, 4899-4902.
- DelMonte, A. J.; Haller, J.; Houk, K. N.; Sharpless, K. B.; Singleton, D. A.; Strassner, T.; Thomas, A. A. J. Am. Chem. Soc. 1997, 119, 9907-9908. doi:10.1021/ja971650e
- Ulf M. Lindström, Rui Ding, Olle Hidestål. . Chemical Communications. 2005, 13: 1773–4.