库林科维奇反应
Kulinkovich反应(Kulinkovich reaction),又称Kulinkovich环丙烷化反应、Kulinkovich环丙化反应(Kulinkovich cyclopropanation),由 O. Kulinkovich 等人在1989年报道。[1][2][3][4][5][6]
| 库林科维奇反应 Kulinkovich reaction | |
|---|---|
| 命名根据 | Oleg Kulinkovich |
| 反应类型 | 成环反应 |
| 标识 | |
| 有机化学网站对应网页 | kulinkovich-reaction |
| RSC序号 | RXNO:0000682 |
在异丙醇钛(Ⅳ)(Ti(OiPr)4)催化下,乙基或更高级的格氏试剂(有β-氢)与酯反应生成环丙醇衍生物。
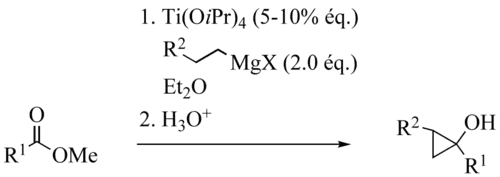
除异丙醇钛外烷氧基钛催化剂还可以是 ClTi(OiPr)3 、 ClTi(OtBu)3 或 Ti(OtBu)4。 常用反应溶剂有乙醚、四氢呋喃和甲苯。 反应物可以带醚、硫醚和亚胺等官能团进行反应。 不过酰胺、伯胺、仲胺与氨基甲酸酯则不在可耐受官能团之列。
这一反应最初使用化学计量的烷氧基钛,逐渐发展到仅使用催化量的烷氧基钛。后来 Corey 又进一步发展了含有TADDOL配体的手性钛催化的不对称反应。[7]
反应机理
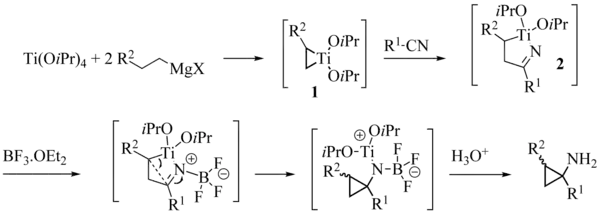
一般认为,反应机理中,首先为两分子格氏试剂与烷氧基钛进行转金属作用,产生一个对热不稳定的二烷基二烷氧基钛络合物,后者很快发生β-氢消除、歧化,放出烷烃并产生一分子取代钛杂环丙烷中间体 (1)。 该中间体作为1,2-双碳负离子等价物,其较弱的 C–Ti 键接受酯羰基的插入反应,得到噁钛杂环戊烷中间体 (2),并接下来重排为酮 (3)。 上述插入过程重复一次,(3) 的羰基分子内插入 C–Ti 键中,再进行一次烷基化,得到环丙醇衍生物中间体 (4)。 这一步是总反应的限速步骤,被还原的钛(Ⅱ)亦在此步骤中被重新氧化为钛(Ⅳ)。 此步的产物 (4) 是一种烷氧基钛化合物,与反应使用的烷氧基钛催化剂类似, (4) 也可以与格氏试剂发生转金属作用,再生烷基钛,从而完成此反应的催化循环。而且,此一步的另一产物环丙醇镁盐 (5),经过水解,即得游离的环丙醇。
若使用比乙基更为高级的格氏试剂,产物中将会产生两个新的立体中心,并且,反应底物中不含螯合基团时,反应也有很高的非对映选择性,这是此反应的一个特点。 有认为此非对映选择性是由于噁钛杂环戊烷 (3)向环丙醇钛盐 (4)转化一步过渡态中,底物的 C–H 键与钛原子之间形成的抓氢键作用而造成的。
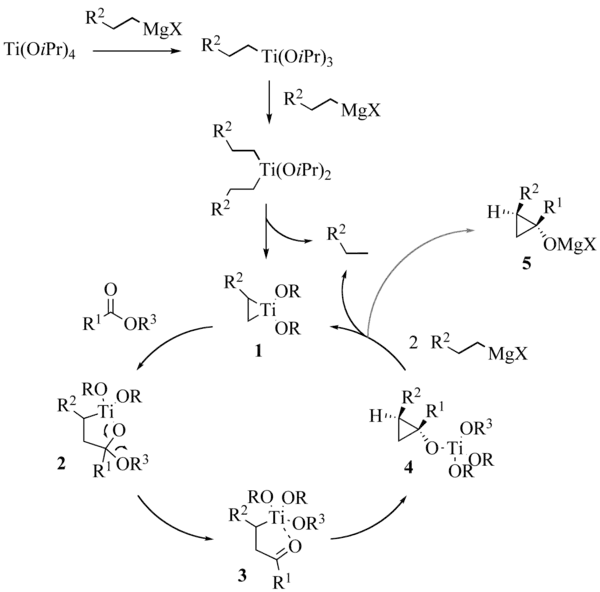
虽然2001年吴云东对此反应的机理进行了系统的理论计算,[6] 但该反应的具体机理在某些方面仍不很清楚,例如,2007年时 Kulinkovich 曾提出反应可能经过钛酸根型阴离子配合物(ate complex)中间体。[8]
使用乙基格氏试剂时,实验测得反应体系除了会产生歧化一步生成的乙烷外,还有少量的乙烯产生。Kulinkovich 认为反应中亦存在取代钛杂环丙烷中间体与异丙醇钛(Ⅳ)发生作用的副反应,两者作用产生两分子的异丙醇钛(Ⅲ),并放出乙烯。[9]
与烯烃的配体交换
从上述机理可以看出,由于反应中存在歧化一步,因此在参与反应的两分子格氏试剂中,实际上只有一分子能用于构建环丙烷环系,另一分子格氏试剂则会转变为烷烃副产物。这一点在反应中所用格氏试剂并不易得时成为反应的一个主要缺点。
1993年 Kulinkovich 等发现钛杂环丙烷可以与烯烃发生配体交换,生成与烯烃相对应的钛杂环丙烷中间体,从而所有参与反应的烯烃都得到利用,而且意味着此反应实际上提供了一种活化烯烃进而与酯反应、形成环丙烷环系的手段,使反应的应用范围得到拓展。[10] 不过后来发现,尽管苯乙烯可以与钛中间体形成络合物,但是其他烯烃,如1-庚烯、α-甲基苯乙烯和乙基乙烯醚却无法反应。 Cha 等用位阻大的环戊烯或环己基格氏试剂解决这一问题。[11]
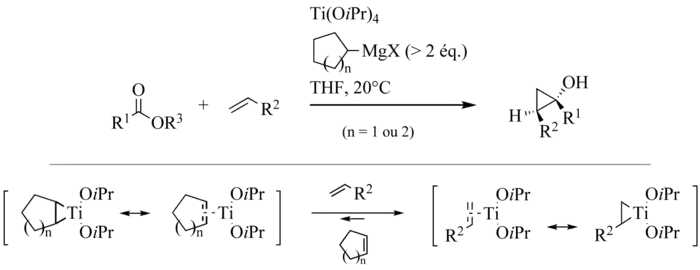
1995年有人将此改进法用于分子内的 Kulinkovich 反应。[12]
此外 de Meijere 还报道了另一种使所有格氏试剂都得到利用的改进法,即先制得 MeTi(OiPr)3,并且使其与格氏试剂以 1:1.1 的比例参与反应。只有一分子格氏试剂与上述钛试剂反应产生交换后生成的异丙醇镁并生成取代钛杂环丙烷中间体。反应的另一个产物则为甲烷。
de Meijere变体
在类似条件下,酰胺可被转化为环丙胺衍生物,称为 de Meijere 变体或 Kulinkovich–de Meijere 反应。[13][14]
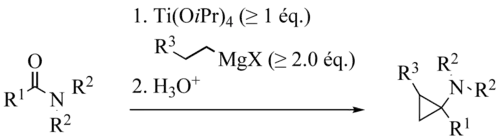
分子内的 Kulinkovich–de Meijere 反应也有报道。[15][16][17][18][19][20][21][22][23][24]
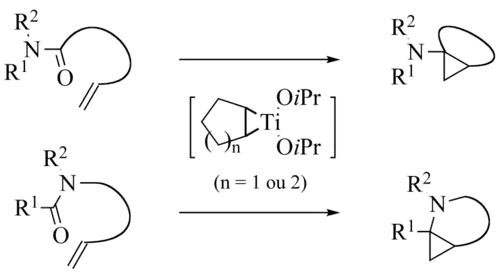
Szymoniak变体
以腈作为底物,得到氨基环丙烷产物,称为 Szymoniak 变体或 Kulinkovich–Szymoniak 反应。[25][26]
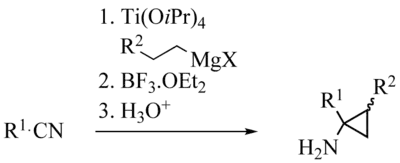
其机理与 Kulinkovich 反应机理类似。
参见
参考资料
- Kulinkovich, O. G.; Sviridov, S. V.; Vasilevskii, D. A.; Pritytskaya, T. S. Zh. Org. Khim., 25, 2244 (1989).
- Oleg G. Kulinkovich, Sergei V. Sviridov, Dmitry A. Vasilevski. . Synthesis. 1991, 1991 (03): 234. doi:10.1055/s-1991-26431.
- Oleg G. Kulinkovich and Armin de Meijere. . Chem. Rev. 2000, 100 (8): 2789–2834. doi:10.1021/cr980046z.
- Fumie Sato, Hirokazu Urabe, and Sentaro Okamoto. . Chem. Rev. 2000, 100 (8): 2835–2886. doi:10.1021/cr990277l.
- O. G. Kulinkovich. . Russ. Chem. Bull. 2005, (5): 1065 [2009-10-26]. (原始内容存档于2016-03-04).
- Yun-Dong Wu and Zhi-Xiang Yu. . J. Am. Chem. Soc. 2001, 123 (24): 5777–5786. doi:10.1021/ja010114q.
- E. J. Corey, S. Achyutha Rao, Mark C. Noe. . J. Am. Chem. Soc. 1994, 116 (20): 9345–9346. doi:10.1021/ja00099a068.
- Oleg G. Kulinkovich, Dzmitry G. Kananovich. . Eur. J. Org. Chem. 2007, 2007 (13): 2121–2132. doi:10.1002/ejoc.200601035.
- Evgenii A. Matiushenkov, Nikolai A. Sokolov, Oleg G. Kulinkovich. . Synlett. 2004: 77–80. doi:10.1055/s-2003-43370.
- Oleg G. Kulinkovich, Andrey I. Savchenko, a, Sergey V. Sviridov, a and Dmitry A. Vasilevski. . Mendeleev Commun. 1993, 3 (6): 230–231. doi:10.1070/MC1993v003n06ABEH000304.
- Jinhwa Lee, Heejin Kim, and Jin Kun Cha. . J. Am. Chem. Soc. 1996, 118 (17): 4198–4199. doi:10.1021/ja954147f.
- Aleksandr Kasatkin and Fumie Sato. . Tetrahedron Lett. 1995, 36 (34): 6079–6082. doi:10.1016/0040-4039(95)01208-Y.
- Dipl.-Chem. Vladimir Chaplinski, Prof. Dr. Armin de Meijere. . Angew. Chem. Int. Ed. Engl. 1996, 35 (4): 413–414. doi:10.1002/anie.199604131.
- Armin de Meijere, Harald Winsel, and Björn Stecker, "Facile Syntheses of Aminocyclopropanes: N,N-Dibenzyl-N-(2-ethenylcyclopropyl)amine (页面存档备份,存于)", Organic Syntheses, Vol. 81, p.14 (2005).
- Jinhwa Lee and Jin Kun Cha. . J. Org. Chem. 1997, 62 (6): 1584–1585. doi:10.1021/jo962368d.
- Vladimir Chaplinski, Harald Winsel, Markus Kordes, Armin de Meijere. . Synlett. 1997, 1997 (01): 111–114. doi:10.1055/s-1997-17828.
- Bin Cao, Dong Xiao, and Madeleine M. Joullié. . Org. Lett. 1999, 1 (11): 1799–1801. doi:10.1021/ol9910520.
- Hee Bong Lee, Moo Je Sung, Silas C. Blackstock, and Jin Kun Cha. . J. Am. Chem. Soc. 2001, 123 (45): 11322–11324. doi:10.1021/ja017043f.
- Martina Gensini, Sergei I. Kozhushkov, Dmitrii S. Yufit, Judith A. K. Howard, Mazen Es-Sayed, Armin de Meijere. . Eur. J. Org. Chem. 2002, 2002 (15): 2499–2507. DOI:
- Gerd-Dieter Tebben, Karsten Rauch, Christian Stratmann, Craig M. Williams, and Armin de Meijere. . Org. Lett. 2003, 5 (4): 483–485. doi:10.1021/ol027352q.
- Nouara Ouhamou and Yvan Six. . Org. Biomol. Chem. 2003, (1): 3007–3009. doi:10.1039/b306719j.
- Martina Gensini, Dr., Armin de Meijere, Prof. Dr. . Chem. Eur. J. 2004, 10 (3): 785–790. doi:10.1002/chem.200305068.
- Laurent Larquetoux, Justyna A. Kowalska, Yvan Six. . Eur. J. Org. Chem. 2004, 2004 (16): 3517–3525. doi:10.1002/ejoc.200400291.
- Laurent Larquetoux, Nouara Ouhamou, Angèle Chiaroni, Yvan Six. . Eur. J. Org. Chem. 2005, 2005 (21): 4654–4662. doi:10.1002/ejoc.200500428.
- Philippe Bertus and Jan Szymoniak. . Chem. Commun. 2001, (18): 1792–1793. doi:10.1039/b105293b.
- Dipl.-Chem. Vladimir Chaplinski, Prof. Dr. Armin de Meijere. . Angew. Chem. Int. Ed. Engl. 1996, 35 (4): 413–414. doi:10.1002/anie.199604131.