氟代烷
氟代烷(通式為,其中代表烷基),屬鹵代烴的一種,指烷烴中的一個或多個氫原子被氟取代的有機化合物。因此氟代烷中只有氟、氫和碳三元素。氟甲烷是結構最簡單的氟代烷。氟代烷的命名跟其他鹵代烷很相似,同樣以IUPAC命名法來命名,找出相應烷烴作爲母體,將氟視作取代基,然後以數字標明其位置[1]。
分類
氟代烷像醇與其他鹵代烷一樣,可以按照連着氟原子的碳所連的碳之數目來去分成伯(一級)、仲(二級),和叔(三級)氟代烷。例如氟甲烷為一級氟代烷。以下是各種氟代烷的結構:
 一級氟代烷的結構
一級氟代烷的結構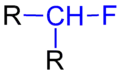 二級氟代烷的結構
二級氟代烷的結構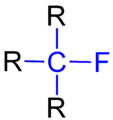 三級氟代烷的結構
三級氟代烷的結構
製備
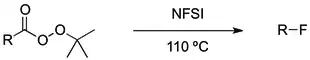
氟代烷不能直接由烷烴和氟氣的自由基鹵代反應反應得到,因爲這反應會釋放大量的熱,使得碳-碳鍵斷裂,生成碳和氟化氫。但可用活性較低的氟化試劑,如三氟化鈷,來製備氟代烴。[2][3]這方法又名 Fowler 法 (Fowler process),反應在高溫進行。
第一步中,二氟化鈷被氟化,生成三氟化鈷。反應式如下:
第二步中,引入有機化合物與三氟化鈷反應:
反應涉及到單電子轉移和碳正離子機理。[4]由於反應中的碳正離子有機會發生重排,所以反應有機會生成很多不同產物。[5]而三氟化鈷則會變回二氟化鈷,可循環再用。反應機理如下:
此外,尚有不少的自由基氟化反應,可以用來製備氟代烷。如下:
反應性
在親核取代反應中,氟代烷的反應性是所有鹵代烷之中最低的。碳-氟鍵是碳-鹵鍵之中最强的,因此最難斷鍵。[12]同時,由於氫鹵酸的强弱順序為HI>HBr>HCl>HF,鹵素離子(其共軛鹼)的鹼性順序為 F->Cl->Br->I-。因此氟離子是鹵素離子中最弱的離去基團,氟代烷在親核取代反應中的反應速率也就是所有鹵代烷之中最低的。[13]
對環境的危害
很多氟代烷都是溫室氣體,全球暖化潛勢(GWP)很高,會加劇溫室效應。例如1,1,1,2-四氟乙烷的全球暖化潛勢相當高,100年GWP為1430。[16]其他屬於溫室氣體的氟代烷有二氟甲烷[17]、1,1,1-三氟乙烷、五氟乙烷[18]等。
参考文献
- 有机化合物命名原则2017 (页面存档备份,存于). 中国化学会. [2018-1-17]
- 邢, 其毅; 裴, 偉偉; 徐, 瑞秋; 裴, 堅. . . 北京. 2017: 270. ISBN 978-7-301-27212-1 (中文).
- Fowler, R. D.; Burford, W. B., III; Hamilton, J. M., Jr.; Sweet, R. G.; Weber, C. E.; Kasper, J. S.; Litant, I. (1947). "Synthesis of Fluorocarbons." Ind. Eng. Chem. 39: 292–298. doi:10.1021/ie50447a612.
- Sandford, G. (2003). " Perfluoroalkanes." Tetrahedron 59: 437–454. doi:10.1016/S0040-4020(02)01568-5.
- Coe, P. L. "Cobalt(III) Fluoride" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.
- Tius, Marcus A. . Tetrahedron. Jun 1995, 51 (24): 6605–6634. doi:10.1016/0040-4020(95)00362-C.
- Rueda-Becerril, Montserrat; Chatalova-Sazepin, Claire; Leung, Joe C. T.; Okbinoglu, Tulin; Kennepohl, Pierre; Paquin, Jean-François; Sammis, Glenn M. . Journal of the American Chemical Society. Mar 2012, 134 (9): 4026–4029. ISSN 0002-7863. PMID 22320293. doi:10.1021/ja211679v.
- Yin, Feng; Wang, Zhentao; Li, Zhaodong; Li, Chaozhong. . Journal of the American Chemical Society. Jun 2012, 134 (25): 10401–10404. ISSN 0002-7863. PMID 22694301. doi:10.1021/ja3048255.
- Huang, Xiongyi; Liu, Wei; Hooker, Jacob M.; Groves, John T. . Angewandte Chemie International Edition. Apr 2015, 54 (17): 5241–5245. ISSN 1521-3773. PMID 25736895. doi:10.1002/anie.201500399.
- Rueda Becerril, Montserrat; Mahé, Olivier; Drouin, Myriam; Majewski, Marek B.; West, Julian G.; Wolf, Michael O.; Sammis, Glenn M.; Paquin, Jean-François. . Journal of the American Chemical Society. Jan 2014, 136 (6): 2637–2641. PMID 24437369. doi:10.1021/ja412083f.
- Ventre, Sandrine; Petronijević, Filip R.; MacMillan, David W. C. . Journal of the American Chemical Society. Apr 2015, 137 (17): 5654–5657. PMC 4862610
 . PMID 25881929. doi:10.1021/jacs.5b02244.
. PMID 25881929. doi:10.1021/jacs.5b02244. - Blanksby SJ, Ellison GB. . Acc. Chem. Res. April 2003, 36 (4): 255–63. PMID 12693923. doi:10.1021/ar020230d.
- 邢, 其毅; 裴, 偉偉; 徐, 瑞秋; 裴, 堅. . . 北京. 2017: 241–242. ISBN 978-7-301-27212-1 (中文).
- Franklin J. . Chemosphere. 1993, 27 (8): 1565–1601. doi:10.1016/0045-6535(93)90251-Y.
- Ann M. Thayer "Fabulous Fluorine" Chemical and Engineering News, June 5, 2006, Volume 84, pp. 15-24. http://pubs.acs.org/cen/coverstory/84/8423cover1.html (页面存档备份,存于)
- Forster, P.; et al. (PDF). . 2007 [2011-12-23]. (原始内容存档 (PDF)于2007-12-15).
- . [2008-07-03]. (原始内容存档于2004-08-25).
- epa.gov reported GWP, published Mar-2006
_Fluoride.png.webp)