氟化铁
氟化鐵,又稱三氟化鐵,氟化鐵(III),是氟和鐵的化合物,化學式是FeF3。无水氟化铁是白色的,水合物则是粉红色的。[3]它具有很强的吸濕性。
| 氟化鐵 | |
|---|---|
 | |
 | |
| 别名 | 三氟化鐵,氟化鐵(III) |
| 识别 | |
| CAS号 | 7783-50-8 15469-38-2(三水) |
| PubChem | 24552 |
| ChemSpider | 22958 |
| SMILES |
|
| InChI |
|
| InChIKey | SHXXPRJOPFJRHA-DFZHHIFOAS |
| RTECS | NO6865000 |
| 性质 | |
| 化学式 | FeF3 |
| 112.84 g·mol⁻¹ | |
| 外观 | 绿色固体[1] |
| 密度 | 3.87 g/cm3 |
| 熔点 | >1000°C |
| 溶解性(水) | 0.91 g/L(20°C)[1] |
| 溶解性 | 微溶于稀氢氟酸[1] 几乎不溶于醇、醚和苯[1] |
| 结构 | |
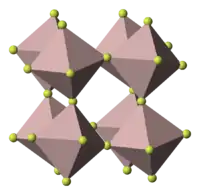
| 晶体结构 | 菱形,hR24 |
| 空间群 | R-3c, No. 167 |
| 危险性 | |
GHS危险性符号  [2] [2] | |
| GHS提示词 | Danger[2] |
| H-术语 | H302, H312, H332, H314[2] |
| P-术语 | P260, P301+330+331, P303+361+353, P305+351+338, P405, P501[2] |
| 主要危害 | 有腐蚀性 |
| 相关物质 | |
| 其他阴离子 | 氧化鐵, 三氯化鐵 |
| 其他阳离子 | 三氟化錳, 三氟化鈷 |
| 相关化学品 | 氟化亚铁 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
化學和物理性質
氟化铁的晶体结构类似三氧化铼,空间群 R-3c。[4]虽然氟化铁没有挥发性,但它在987 °C时会蒸发,产生的FeF3气体有D3h对称性,三个Fe-F键的键长都是176.3 pm。[5]氟化铁在极高的温度下分解成FeF2和F2。[4]
製造、存在、反应
无水氟化铁可以由氟气和几乎所有无水铁化合物反应而成。它也可以由無水氫氟酸或氟與三氯化鐵反應製得。[6]亦可由氧化鐵在高溫下與氟化氫氣體反應製得。
- FeCl3 + 3 HF → FeF3 + 3 HCl
它是铁被氟化氢钝化的产物。[7]水合氟化铁可在氢氟酸中结晶。[8]
氟化铁是氟离子受体。它和六氟化氙反应,形成[XeF5][FeF4]。[4]
无水FeF3矿物仍未被发现,不过水合氟化铁存在于非常稀有的矿物topsøeite(化学式 FeF[F0.5(H2O)0.5]4·H2O)中。[9][10]
参考资料
- hrsg. von Georg Brauer. Unter Mitarb. von M. Baudler. . Stuttgart: Enke. 1975: 275. ISBN 3-432-02328-6. OCLC 310719485 (德语).
- . American Elements. [November 5, 2018]. (原始内容存档于2021-05-17).
- Housecroft, Catherine E.; Sharpe, Alan G. (2008) Inorganic Chemistry (3rd ed.), Pearson: Prentice Hall. ISBN 978-0-13-175553-6.
- Greenwood, N. N.; Earnshaw, A. 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- Hargittai, M.; Kolonits, M.; Tremmel, J.; Fourquet. J.; Ferey, G. . Structural Chemistry. January 1990, 1 (1): 75–78. S2CID 96178006. doi:10.1007/BF00675786.
- Handbook of Preparative Inorganic Chemistry, 2nd Ed. Edited by G. Brauer, Academic Press, 1963, NY. Vol. 1. p. 266-7.
- J. Aigueperse, P. Mollard, D. Devilliers, M. Chemla, R. Faron, R. Romano, J. P. Cuer, "Fluorine Compounds, Inorganic" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005.doi:10.1002/14356007.a11_307
- Karraker, D. G.; Smith, P. K. . Inorganic Chemistry. March 1992, 31 (6): 1118–1120. doi:10.1021/ic00032a042.
- . [2021-05-17]. (原始内容存档于2020-11-16).
- . [2021-05-17]. (原始内容存档于2021-12-20).
- "Ferric Fluoride." CAMEO Chemicals. National Oceanic and Atmospheric Administration. Web. 7 Apr. 2010. <http://cameochemicals.noaa.gov/chemical/3468 (页面存档备份,存于)>
- Bandgar, B. T.; Kamble, V. T. . Green Chemistry. July 2001, 3 (5): 265. doi:10.1039/b106872p.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.