氢化铀
| 氢化铀 | |
|---|---|
 | |
| 别名 | 氢化铀(III)[1] 三氢化铀[2][3] |
| 识别 | |
| CAS号 | 13598-56-6 |
| ChemSpider | 25935465 |
| SMILES |
|
| 性质 | |
| 化学式 | UH 3 |
| 241.05273 g·mol⁻¹ | |
| 密度 | 10.95 g cm−3 |
| 溶解性(水) | 反应 |
| 结构 | |
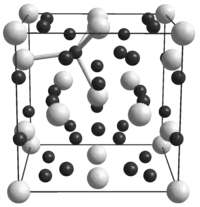
| 晶体结构 | 立方晶系,cP32 |
| 空间群 | Pm3n, No. 223 |
| 晶格常数 | a = 664.3 pm[4] |
| 危险性 | |
| MSDS | ibilabs.com |
| 闪点 | 自燃 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
性质
氢化铀是一种剧毒的棕褐色至棕黑色,可自燃粉末或脆性固体。 它在 20°C 下的密度是 10.95 g cm−3,大大低于铀的密度 (19.1 g cm−3)。 它具有金属导电性,在盐酸中微溶,在硝酸中分解。
一共存在氢化铀的两种晶体,均为立方晶体:在低温下获得的α形式和在温度高于250℃时产生的β形式。[5] 两种形式在室温及低于室温的温度下都是亚稳态的,但加热至100°C时,α形式会缓慢转变为β形式。[3] α-和β-UH3在低于~180 K的温度下均为铁磁性。 高于180 K时,它们是顺磁性的。[6]
以铀金属为原料制备
和氢气的反应
铀金属暴露于氢气中会导致氢脆。氢在金属中扩散并在晶粒边界形成脆性氢化物的网络。通过真空中的退火可以除去其中的氢并恢复延展性。[7]
金属铀加热到 250 至300 °C (482 至572 °F) 会和氢气反应,形成氢化铀。 加热到 500°C 则会释放氢气。 此特性使氢化铀成为各种铀的碳化物、氮化物和卤化物的理想原料,可用于制备反应性铀粉末。[5] 这个可逆反应如下:[2]
- 2 U + 3 H2 ⇌ 2 UH3
氢化铀不是间隙化合物,导致金属在形成氢化物时膨胀。 在其晶格中,每个铀原子被另外6个铀原子和12个氢原子包围;每个氢原子在晶格中占据一个大的四面体孔。[8] 氢化铀中的氢密度与液态水或液态氢中的氢密度大致相同。[9] 通过氢原子的U-H-U桥键存在于结构中。[10]
和水的反应
当铀金属暴露在水中时,会形成氢化铀。反应进行如下:
- 7 U + 6 H2O → 3 UO2 + 4 UH3
这时产生的氢化铀是可自燃的;如果此后将金属(例如 : 损坏的燃料棒)暴露在空气中,则可能会产生过多的热量,并且铀金属本身也会燃烧。[11] 通过暴露于98%氦与2%氧的气体混合物中,可以将被氢化物污染的铀钝化。[12] 铀金属上的冷凝水促进了氢和氢化铀的形成;在没有氧的情况下可以形成可自燃表面。[13] 这给乏核燃料池中的乏核燃料的水下储存带来了问题。根据氢化物颗粒的大小和分布,在不确定的暴露时间后会发生自燃。[14] 这样的暴露带来放射性废物储存库中燃料碎片自燃的风险。[15]
暴露于蒸汽中的铀金属产生氢化铀和二氧化铀的混合物。[8]
应用
氢 ,氘和氚可通过与铀反应 , 然后热分解生成的氢化物/氘化物/氚化物来纯化。 [17] 数十年来,人们已经从氢化铀中制备了极其纯净的氢气。 [18] 加热氢化铀是将氢引入真空系统的便捷方法。 [19]
如果粉末状的氢化铀发生热分解,则氢化铀合成时的溶胀和粉碎可用于制备非常细的铀金属。
参考文献
- Carl L. Yaws. . William Andrew. 2008: 307– [11 October 2011]. ISBN 978-0-8155-1596-8. (原始内容存档于2014-01-01).
- Egon Wiberg; Nils Wiberg; Arnold Frederick Holleman. . Academic Press. 2001: 239– [11 October 2011]. ISBN 978-0-12-352651-9. (原始内容存档于2014-01-01).
- Gerd Meyer; Lester R. Morss. . Springer. 1991: 44– [11 October 2011]. ISBN 978-0-7923-1018-1. (原始内容存档于2014-01-01).
- Bartscher W., Boeuf A., Caciuffo R., Fournier J.M., Kuhs W.F., Rebizant J., Rustichelli F. . Solid State Commun. 1985, 53: 423–426. doi:10.1016/0038-1098(85)91000-2.
- Seaborg, Glenn T. . . Skokie, Illinois: Reinhold Book Corporation. 1968: 782. LCCCN 68-29938.
- K. H. J. Buschow. . Elsevier. 2005: 901– [11 October 2011]. ISBN 978-0-08-044586-1. (原始内容存档于2022-02-08).
- I. N. Toumanov. . Nova Publishers. 2003: 232 [2010-02-07]. ISBN 1-59033-009-9.
- Amit Arora. . Discovery Publishing House. 2005: 789 [2010-02-07]. ISBN 81-8356-013-X.
- Peter Gevorkian. . McGraw Hill Professional. 2009: 393 [2010-02-07]. ISBN 978-0-07-162147-2.
- G. Singh. . Discovery Publishing House. 2007 [2010-02-07]. ISBN 978-81-8356-241-6.
- . Bulletin of the Atomic Scientists. 1994, 50 (5): 49 [2010-02-07].
- . Teton.if.uidaho.edu. [2010-02-07]. (原始内容存档于2009-09-30).
- OECD Nuclear Energy Agency. . OECD Publishing. 2006: 176 [2010-02-07]. ISBN 92-64-02485-9.
- Abir Al-Tabbaa; J. A. Stegemann. . Taylor & Francis. 2005: 197 [2010-02-07]. ISBN 0-415-37460-X.
- . John Wiley and Sons. 2001: 278 [2010-02-07]. ISBN 1-86058-329-6.
- . Osha.gov. [2010-02-07]. (原始内容存档于2010-03-22).
- E. E. Shpil'rain. . Springer. 1987: 104 [2010-02-07]. ISBN 0-88318-532-6. (原始内容存档于2022-02-08).
- Yuda Yürüm. . Springer. 1995: 264 [2010-02-07]. ISBN 0-7923-3601-1. (原始内容存档于2022-02-08).
- Fred Rosebury. . Springer. 1992: 121 [2010-02-07]. ISBN 1-56396-121-0. (原始内容存档于2022-02-08).