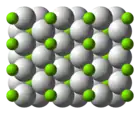
氫化鎂
氫化鎂,又稱二氫化鎂,一種白色結晶,易燃和具刺激性。可用作強還原劑。屬共價型氫化物,呈弱鹼性,可通过氢桥键形成聚合物,类似于氢化铝和氢化铍。[1]
| 氫化鎂 | |||
|---|---|---|---|
| |||
| IUPAC名 Magnesium hydride | |||
| 英文名 | |||
| 别名 | 二氫化鎂 | ||
| 识别 | |||
| CAS号 | 7693-27-8 | ||
| PubChem | 107663 | ||
| ChemSpider | 16787263 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | RSHAOIXHUHAZPM-HZAFDXBCAG | ||
| 性质 | |||
| 化学式 | MgH2 | ||
| 26.3209 g·mol⁻¹ | |||
| 外观 | 白色晶體 | ||
| 密度 | 1.45 g/cm3 | ||
| 熔点 | 327 °C | ||
| 溶解性(水) | 分解 | ||
| 结构 | |||
| 晶体结构 | 四方晶系[1] | ||
| 危险性 | |||
欧盟危险性符号 易燃 F 易燃 F 刺激性 Xi 刺激性 Xi | |||
| 警示术语 | R:R15, R11, R36/37/38[2] | ||
| 安全术语 | S:S8, S43, S36/37/39, S26, S16, S7[2] | ||
| 欧盟编号 | 未列出 | ||
| 主要危害 | 自燃[3] | ||
| 相关物质 | |||
| 其他阳离子 | 氫化鈹 氫化鈣 氫化鍶 氫化鋇 | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
性質
- MgH2 + 2H2O → 2H2 + Mg(OH)2
- MgH2 → Mg + H2
- MgH2 + O2 → MgO + H2O
製備
氫化鎂被發現於1912年,[5]當熱解乙基碘化鎂(一種格氏試劑)時,會生成少量氫化鎂。 1951年有一項研究報告描述,將鎂暴露在氫气中加熱加壓到200大氣壓和500℃時兩者发生反應,生成氫化鎂。
- Mg + H2 → MgH2
結構和成鍵
在室溫下形成的氫化鎂為β-MgH2,具有金红石型二氧化鈦的結構,[7],高壓形成的氫化鎂則有兩種結構形式,α-PbO2型α-MgH2和γ-MgH2。[8][9]
氫氣存在下,將鎂用激光消融得到的試樣,用基質隔離的方法在10開爾文以下用振動光譜分析,可以鑒別出MgH、MgH2、Mg2H、Mg2H2、Mg2H3及Mg2H4這些氫化鎂的分子形式。[10]
 在室溫下的β-MgH2分子結構
在室溫下的β-MgH2分子結構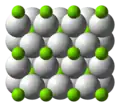 α-PbO2型α-MgH2結構
α-PbO2型α-MgH2結構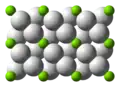 γ-MgH2結構
γ-MgH2結構 鎂原子的配位情況
鎂原子的配位情況 氫原子的配位情況
氫原子的配位情況
用途
- 製備無機聚合型氫化物[1]
- 作為儲氫介質
參見
- 氫化鋁 · 氫化硼
參考來源
- (简体中文)化工词典 氢化镁 (页面存档备份,存于)
- (简体中文)ChemicalBook 二氫化鎂
- Synthesis of magnesium hydride by the reaction of phenylsilane and dibutylmagnesium , Michalczyk M.J., Organometallics; (1992); 11(6); 2307-2309. doi:10.1021/om00042a055
- Hydrogen-storage materials for mobile applications, L. Schlapbach and A. Züttel, Nature 414, 353 (2001).doi:10.1038/35104634 (页面存档备份,存于)
- Jolibois, Compte Rendu, 155, 353,(1912)
- Wiberg, Goeltzer, Bauer,1951, Z naturforsch 6b, 394, (1951)
- Neutron diffraction study of magnesium deuteride, Zachariasen W.H., Holley C.E, Stamper J.F. Jnr, Acta Cryst. (1963) 16, 352-353, doi:10.1107/S0365110X63000967
- Michael D. Hampton, Dmitry V. Schur, Svetlana Yu. Zaginaichenko, V. I. Trefilov, Hydrogen Materials Science and Chemistry of Metal Hydrides: Proceedings of the NATO Advanced Research Workshop, Katsiveli, Yalta, Ukraine, 2002, Springer, ISBN 1402007302
- Structure of the high pressure phase γ-MgH2 by neutron powder diffraction, Bortz M., Bertheville B., Böttger G., Yvon K., Journal of Alloys and Compounds, 287, 1-2, (1999), L4-L6, doi:10.1016/S0925-8388(99)00028-6
- Infrared Spectra of Magnesium Hydride Molecules, Complexes, and Solid Magnesium Dihydride, Xuefeng Wang and Lester Andrews, J. Phys. Chem. A, 108 (52), 11511 -11520, 2004. doi:10.1021/jp046410h
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.