玛巴洛沙韦
玛巴洛沙韦,商品名速福达,是一种用于治疗甲型流感和乙型流感的抗病毒药物。[6]可将流感症状的持续时间缩短大约一天,但很容易筛选出耐药突变体病毒使其失效。[7]
 | |
| 臨床資料 | |
|---|---|
| 商品名 | Xofluza |
| 其他名稱 | BXM (S-033188), BXA (S-033447) |
| AHFS/Drugs.com | Monograph |
| MedlinePlus | a618062 |
| 核准狀況 |
|
| 懷孕分級 | |
| 给药途径 | 口服给药 |
| ATC碼 | |
| 法律規範狀態 | |
| 法律規範 | |
| 识别 | |
| |
| CAS号 | 1985606-14-1 |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| 化学 | |
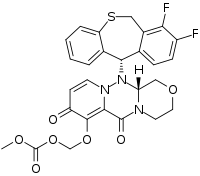
| 化学式 | C27H23F2N3O7S |
| 摩尔质量 | 571.55 g·mol−1 |
| 3D模型(JSmol) | |
| |
| |
玛巴洛沙韦为前体药物,以人体内代谢时的中间产物“巴洛沙韦”(baloxavir acid, BXA)作为酶抑制剂,靶向作用于流感病毒的5′端帽依赖性核糖核酸內切酶并抑制其活性。[8]因此,其作用机制不同于奥司他韦等神经氨酸酶抑制剂和扎那米韦。[9]该药半衰期较长,全程只需一次服用[10]。
历史
玛巴洛沙韦由日本盐野义制药公司研发,此后瑞士罗氏制药公司与其达成合作,双方共同负责玛巴洛沙韦的研发和商业推广[12],同时罗氏还负责在除日本与台湾外的世界范围内进行销售[13]。同年,日本和美国批准该药物的临床使用[14][15][16]并作为口服单剂。[6]
2021年4月27日,中国国家药品监督管理局获批了该药物的临床使用,用于治疗12周岁及以上急性无并发症的流感患者,包括存在流感并发症高风险的患者[17]。同年12月,该药物被列入中国医保乙类药物[12]。
2022年10月11日,石藥集團欧意药业仿制药玛巴洛沙韦片在中国获批上市,同月18日,罗氏制药发布声明指控其涉嫌侵犯专利,已提起专利链接诉讼[18]。同时,据《中华人民共和国专利法》第七十五条第五款规定,用于申请上市审批而制造仿制药的不视为侵犯专利权。同年12月16日,罗氏制药删除该则声明[10]。2023年3月,中国批准该药物的适龄人群扩龄至5岁及以上患者[10]。2022年10月11日
美国食品和药物管理局认为可作为玛巴洛沙韦临床一线用药[19]。
参考文献
- . Therapeutic Goods Administration (TGA). 2020-03-02 [2020-08-16]. (原始内容存档于2020-03-13).
- . Health Canada. 2012-04-25 [2022-05-29]. (原始内容存档于2022-08-12).
- . Health Canada. 2014-10-23 [2022-05-29]. (原始内容存档于2022-05-31).
- . European Medicines Agency (EMA). 2020-11-09 [2021-01-25]. (原始内容存档于2021-01-30). Text was copied from this source which is copyright European Medicines Agency. Reproduction is authorized provided the source is acknowledged.
- . Union Register of medicinal products. [2023-03-03]. (原始内容存档于2023-03-05).
- . DailyMed. 2019-10-28 [2020-01-09]. (原始内容存档于2020-10-28).
- . Huateng Pharma. [2020-05-29]. (原始内容存档于2021-02-24).
- Noshi T, Kitano M, Taniguchi K, Yamamoto A, Omoto S, Baba K, et al. . Antiviral Res. December 2018, 160: 109–117. PMID 30316915. doi:10.1016/j.antiviral.2018.10.008
 .
. - O'Hanlon, Ryan; Shaw, Megan L. . Current Opinion in Virology. April 2019, 35: 14–18 [2020-09-28]. ISSN 1879-6265. PMID 30852344. S2CID 73726080. doi:10.1016/j.coviro.2019.01.006. (原始内容存档于2021-11-04).
- 红星新闻. . 济宁新闻网. 2023-12-17 [2023-12-17].
- (新闻稿). U.S. Food and Drug Administration (FDA). 2020-11-23 [2020-11-23]. (原始内容存档于2020-11-23).
 本文含有此來源中屬於公有领域的内容。
本文含有此來源中屬於公有领域的内容。 - 药通社. . 药融云. [2023-12-17].
- . Roche. [2023-12-17]. (原始内容存档于2023-05-28) (英语).
- (新闻稿). U.S. Food and Drug Administration (FDA). 2018-10-24 [2019-10-23]. (原始内容存档于2019-10-24).
 本文含有此來源中屬於公有领域的内容。
本文含有此來源中屬於公有领域的内容。 - . U.S. Food and Drug Administration (FDA). 2018-12-07 [2020-05-10]. (原始内容存档于2020-07-26).
 本文含有此來源中屬於公有领域的内容。
本文含有此來源中屬於公有领域的内容。 - (PDF). U.S. Food and Drug Administration (FDA). 2019-10-16 [2020-09-30]. (原始内容存档 (PDF)于2021-04-09).
 本文含有此來源中屬於公有领域的内容。
本文含有此來源中屬於公有领域的内容。 - 药融圈. . 药融云. [2023-12-17]. (原始内容存档于2023-05-10).
- . 21经济网. 2022-10-19 [2023-12-17]. (原始内容存档于2023-02-03).
- (PDF) (报告). U.S. Food and Drug Administration (FDA). January 2019 [2020-09-16]. (原始内容存档于2020-09-17).
 本文含有此來源中屬於公有领域的内容。
本文含有此來源中屬於公有领域的内容。
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.