环丁二烯
环丁二烯是最简单的[n]-轮烯([4]-轮烯),化学式为C4H4。它是一种极不稳定的碳氢化合物,仅能单独存在5秒钟。尽管环丁二烯含有交替的单双键,但是它不符合休克尔规则,因为它只有4个π电子,不符合4n+2的通式。由于金属原子可提供2个电子,所以有些环丁二烯-金属化合物实际上是稳定的。
| 环丁二烯 | |||
|---|---|---|---|
| |||
| IUPAC名 1,3-Cyclobutadiene | |||
| 别名 | 1,3-环丁二烯,[4]轮烯 | ||
| 识别 | |||
| CAS号 | 1120-53-2 | ||
| PubChem | 136879 | ||
| ChemSpider | 120626 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | HWEQKSVYKBUIIK-UHFFFAOYAI | ||
| ChEBI | 33657 | ||
| 性质 | |||
| 化学式 | C4H4 | ||
| 52.07 g·mol⁻¹ | |||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
由于环丁二烯的π电子总能量要高于相应脂肪烃——1,3-丁二烯,因此它被称为是反芳香性的。然而最近的红外光谱数据表明,环丁二烯并非正方形结构,而为长方形,而且1,2-二氘代-1,3-环丁二烯存在两个立体异构体。这说明其π电子具有部分定域性質,因而环丁二烯也不完全是反芳香性的。至于它不是正方形结构的原因,可以将它看作姜-泰勒效应在有机化学中的一个特殊应用。
环丁二烯在35K通过自身Diels-Alder反应二聚。
合成
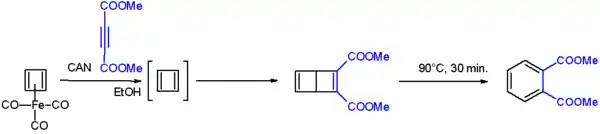
在多次失败的尝试之后,德克萨斯州大学的Rowland Pettit终于在1965年首先制得环丁二烯,但他没能将它分离出来。他先用Fe4(CO)9和cis-二氯环丁二烯通过二次脱卤化氢反应来制备三羰基环丁二烯合铁(C4H4Fe(CO)3),再用硝酸铈铵氧化该络合物:[1][2]
独立存在的环丁二烯会与缺电子的炔烃反应,产物是杜瓦苯衍生物:[3]
该杜瓦苯衍生物加热至90°C分解为邻苯二甲酸二甲酯。
用二炔的[2+2]环加成反应也可以制取环丁二烯的衍生物:以2,3,4,5-四苯基环戊-2,4-二酮作为捕获试剂,脱羰基后产物之一是环辛四烯的衍生物。[4]
参考资料
- Cyclobutadiene- and Benzocyclobutadiene-Iron Tricarbonyl Complexes G. F. Emerson, L. Watts, R. Pettit; J. Am. Chem. Soc.; 1965; 87(1); 131-133. First Page (页面存档备份,存于)
- Iron, tricarbonyl (η4-1,3-cyclobutadiene)- R. Pettit and J. Henery Organic Syntheses, Coll. Vol. 6, p.310 (1988); Vol. 50, p.21 (1970) Link (页面存档备份,存于)
- Cyclobutadiene L. Watts, J. D. Fitzpatrick, R. Pettit J. Am. Chem. Soc.; 1965; 87(14); 3253-3254. Abstract (页面存档备份,存于)
- Revisit of the Dessy-White Intramolecular Acetylene-Acetylene [2 + 2] Cycloadditions Chung-Chieh Lee, Man-kit Leung, Gene-Hsiang Lee, Yi-Hung Liu, and Shie-Ming Peng J. Org. Chem.; 2006; 71(22) pp 8417 - 8423; (Article) doi:10.1021/jo061334v
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.
![二炔[2+2]环加成反应](../I/CyclobutadienSynthDessyWhite.png.webp)