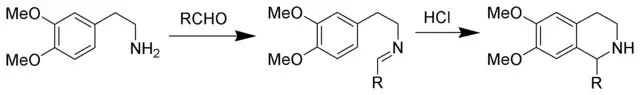
皮克特-施彭格勒反应
Pictet–Spengler反应(P-S反应),又称Pictet–Spengler合成
β-芳基乙胺在酸性条件下与羰基化合物(如醛)缩合再环化为1,2,3,4-四氢异喹啉。[1][2]
反应由瑞士化学家 Amé Pictet 和 Theodor Spengler 在1911年报道,至今已有将近100年的历史,现在该反应仍是合成四氢异喹啉和 β-咔啉衍生物最为有效的方法,常用于异喹啉类生物碱和药物的合成中。[3] 酱油和番茄酱中的色氨酸与醛糖之间也存在类似的反应。
这个反应可以看作是 Mannich 反应的特殊例子,也可看作是 Bischler–Napieralski 反应的一种改进法。
反应一般需要酸催化和加热的条件,但 1934 年 Hahn 等报道了活性较高的化合物在温和条件下进行的 Pictet–Spengler 反应。[4] 1944 年 Schöpf 等也发现高度活性的羟基取代的芳环可使 Pictet–Spengler 反应在温和的接近生理的条件下进行。[5]
芳香乙胺的芳香核的反应性能和羰基化合物的性质对于反应能否进行有很大的影响。芳香核的闭环位置上电子云的密度增加有利于反应的进行。由于反应中的 Mannich 型亲电试剂亚胺正离子的亲电性比 Bischler–Napieralski 反应中的中间体弱,因此要有效地环化,芳环的适当位置必须要有强的活化基团。如果芳环上的活化基团位于间位,关环在活化基团的对位发生;活化基团在邻位或对位则不发生关环反应。当芳环为富电子的吲哚或吡咯环时,反应可以在无酸催化的条件下进行,但反应需要在高沸点溶剂如二甲苯中进行。[6]
最常用的羰基化合物为甲醛、甲醛缩二甲醇。甲醛在许多例子中能得到较好的产率。酮类一般反应结果不理想。
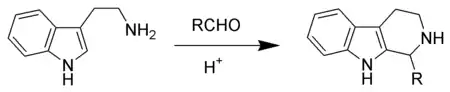
最常用的乙胺衍生物为取代苯乙胺、吡咯乙胺、β-吲哚乙胺(色胺),其中以 β-吲哚乙胺的应用最为广泛。
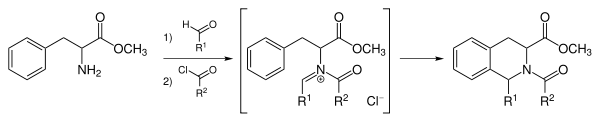
在固相合成中引入 Pictet–Spengler 反应利用组合化学合成小分子生物碱化合物库已经成为 Pictet–Spengler 反应研究的热点领域之一。[7][8] 不对称的 Pictet–Spengler 反应是该类研究的另一个热点领域。[9][10][11][12]
β-芳基乙醇也能发生类似的反应,称为“氧杂-Pictet–Spengler 反应”(Oxa-Pictet-Spengler reaction)。
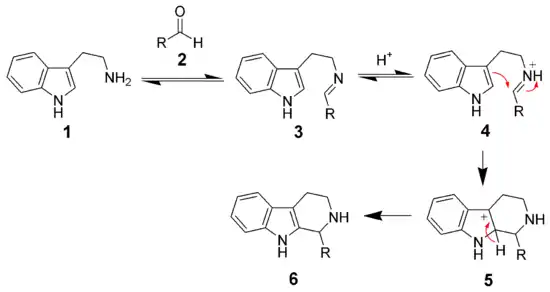
反应机理
β-芳香乙胺与醛在酸性条件下缩合脱水为亚胺(席夫碱),然后亚胺质子化后形成的亚胺离子作为亲电试剂,对芳环进行亲电芳香取代发生环化,便得到四氢异喹啉。[13] 这是一个 6-endo-trig 关环反应,Baldwin规则预测该环化反应是有利的(favoured)。
变体
参考资料
- Pictet, A.; Spengler, T. . Chemische Berichte. 1911, 44: 2030–2036. doi:10.1002/cber.19110440309.
- Whaley, W. M.; Govindachari, T. R. . Org. React. 1951, 6: 74.
- Maria Chrzanowska and Maria D. Rozwadowska. . Chem. Rev. 2004, 104 (7): 3341–3370. doi:10.1021/cr030692k.
- Hahn G., Ludewig H. . Chemische Berichte. 1934, 67 (12): 2031–2035. doi:10.1002/cber.19340671221.
- Clemens Schöpf, Walter Salzer. . Justus Liebigs Ann. Chem. 1944, 544 (1): 1–30. doi:10.1002/jlac.19405440102.
- 程辟,陈纪军. . 化学通报. 2006, 69.
- Nielsen, T. E.; Diness, F.; Meldal, M. . Curr. Opin. Drug Discov. Devel. 2003, 6: 801–814.
- Nielsen, T. E.; Meldal, M. . J. Comb. Chem. 2005, 7: 599–610. doi:10.1021/cc050008a.
- Gremmen, C.; Willemse, B.; Wanner, M. J.; Koomen, G.-J. . Org. Lett. 2000, 2: 1955–1958. doi:10.1021/ol006034t.
- a) The intermolecular Pictet-Spengler condensation with chiral carbonyl derivatives in the stereoselective syntheses of optically-active isoquinoline and indole alkaloids Enrique L. Larghi, Marcela Amongero, Andrea B. J. Bracca, and Teodoro S. Kaufman Arkivoc (RL-1554K) pp 98-153 2005 (Online Review); b) Teodoro S. Kaufman “Synthesis of Optically-Active Isoquinoline and Indole Alkaloids Employing the Pictet-Spengler Condensation with Removable Chiral Auxiliaries Bound to Nitrogen”. in “New Methods for the Asymmetric Synthesis of Nitrogen Heterocycles”; Ed.: J. L. Vicario. ISBN 81-7736-278-X. Research SignPost, Trivandrum, India. 2005. Chapter 4, pp. 99-147.
- Seayad, J.; Seayad, A. M.; List, B. . J. Am. Chem. Soc. 2006, 128: 1086–1087. doi:10.1021/ja057444l.
- Ungemach, F. . J. Am. Chem. Soc. 1980, 102: 6976. doi:10.1021/ja00543a012.
- Cox and Cook. . Chemical Reviews. 1995, 95 (6): 1800–1802. doi:10.1021/cr00038a004.
- Yokoyama, Akihiro. . J. Org. Chem. 1999, 64: 611–617. doi:10.1021/jo982019e.
- B. E. Maryanoff, H.-C. Zhang, J. H. Cohen, I. J. Turchi, and C. A. Maryanoff. . Chem. Rev. 2004, 104: 1431–1628. doi:10.1021/cr0306182.
- Bonnet, D.; Ganesan, A. . J. Comb. Chem. 2002, 4 (6): 546–548. doi:10.1021/cc020026h.
- Youn, S. W. . J. Org. Chem. 2006, 71: 2521–2523. doi:10.1021/jo0524775.