硝酰氟
硝酰氟(化学式:NO2F)是最常见的硝酰盐之一。它首先由莫瓦桑于1905年制得。[1][2][3]
| 硝酰氟 | |||
|---|---|---|---|
| |||
| 识别 | |||
| CAS号 | 10022-50-1 | ||
| PubChem | 66203 | ||
| ChemSpider | 59588 | ||
| SMILES |
| ||
| InChI |
| ||
| InChIKey | JVJQPDTXIALXOG-UHFFFAOYAU | ||
| EINECS | 233-021-0 | ||
| 性质 | |||
| 化学式 | NO2F | ||
| 65.0039 g·mol⁻¹ | |||
| 熔点 | -166 °C | ||
| 沸点 | -72 °C | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
性质
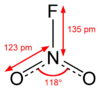
硝酰氟与硝酸根离子是等电子体,也为平面结构。通常状态下为无色气体,共价性较强,熔点-166°C,沸点-72.5°C,N-F键长135pm,偶极矩0.47D。[4]ΔHf°(298K)为-80kJ/mol,ΔGf°(298K)为-37.2kJ/mol。溶于氟化氢时,完全离解为直线型的 [NO2]+ 离子。[5]
硝酰氟是很强的氧化剂和氟化剂,同時有很強的硝化性,可以将大部分金属转化为相应的氧化物、氟化物或氟氧化物,也可以与大部分非金属反应,生成硝酰盐,與有機物反應則生成對應的硝基取代物。比如它与金属锌反应时,会生成氧化锌和氟化锌的混合物,而与金属铬反应,则生成铬酰氟(CrO2F2)。
硝酰氟也可作为 F− 供体。它与三氧化硫反应,可以得到 NO2(SO3F);[6] 与七氟化碘反应,生成 [NO2]+[IF8]−。此外硝酰氟也可作配体,不过对应的配合物较为罕见。
用途
用作火箭推进剂中的氧化剂。[7]
参考资料
- Moissan, H.; Lebeau, P., C. R. Hebd. Seances Acad. Sci. 1940, 1573 (1905).
- Moissan, H.; Lebeau, P., C. R. Hebd. Seances Acad. Sci. 1940, 1621 (1905).
- Moissan, H.; Lebeau, P., Ann. Chim. Phys. 9, 221 (1906).
- Cotton, F. Albert; Wilkinson, Geoffrey (1988), Advanced Inorganic Chemistry (5th ed.), New York: Wiley-Interscience, p. 333, ISBN 0-471-84997-9
- Griffiths, J. E.; Sunder, W. A. J. Fluorine Chem. 6, 533 (1975).
- Schmutzler, R., Angew. Chem. Int. Ed. Engl. 7, 440 (1968).
- Merck Index, 13th edition (2001), p.1193
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.