硫化銅
硫化铜是一种铜和硫的化合物,化学式CuS,在自然界中以深蓝色的靛铜矿形式存在。它是一种中等导电性的导体。[4] 硫化氢气体通入铜盐溶液时可形成硫化铜的胶状沉淀。[5] 目前也有研究發現硫化铜可用在催化[6] 和光电性[7] 的應用上。
| 硫化銅 | |
|---|---|
 | |
| IUPAC名 Copper(II) sulfide 硫化铜 | |
| 别名 | 靛铜矿 硫化铜(II) |
| 识别 | |
| CAS号 | 1317-40-4 ? |
| PubChem | 14831 |
| SMILES |
|
| RTECS | GL8912000 |
| 性质 | |
| 化学式 | CuS |
| 95.611[1] g·mol⁻¹ | |
| 外观 | 黑色六方晶体[1] |
| 密度 | 4.76 g/cm3[1] |
| 熔点 | 507°C[1](转化为硫化亚铜 [1][2]) |
| 溶解性(水) | 难溶[1] |
| 溶度积Ksp | 8.0 x 10-34 |
| 溶解性 | 难溶于稀酸,强碱溶液,乙醇[1]溶于硝酸、氰化钾 |
| 折光度n D |
1.45 [3] |
| 结构 | |
| 晶体结构 | 六方[1] |
| 相关物质 | |
| 其他阴离子 | 氧化铜 |
| 其他阳离子 | 硫化锌 |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
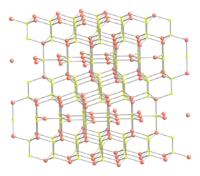
结构
硫化铜(靛铜矿)以六方晶系形式结晶,也存在一种不定型的高压形式,[8] 是以拉曼光譜學为基础,被描述为一种扭曲的靛铜矿形式的结构。由铜(II)乙二胺配合物与硫脲在常温下反应也可得一种不定型的半导体硫化铜,在30°C时转化为靛铜矿结构。[9]
硫化铜的晶体结构被多次报道。[10][11][12] Wells形容此结构“特别”,[13] 它与氧化铜的晶体结构很不相同,但与硒化铜(CuSe)的结构相似。硫化铜晶胞包含6个CuS(12个原子),其中
- 4个铜原子成四面体结构。
- 2个铜原子成平面三角形结构。
- 2对硫原子的距离仅207.1 pm,[12] 证明了S-S键(二硫键)的存在。
- 剩下的两个硫原子形成围绕铜原子的三角形结构,并且这两个硫原子也被5个构成五角双锥结构的铜原子围绕。
- 二硫键中的两个硫原子中的一个与3个四面体构型的铜原子配位。
硫化铜CuIIS(不含硫硫键)与晶体结构不相符合,与观测到的抗磁性不吻合,[14] 因为Cu(II)化合物具d9排布,应为顺磁性物质。[5]
使用XPS技术的研究[15][16][17][18] 表明所有的铜原子均具有+1的氧化态。这与许多课本中的八隅律相违背。[5] 通常课本认为CuS同时具有CuI和CuII,也就是(Cu+)2Cu2+(S2)2–S2–。另外一种化学式(Cu+)3(S2–)(S2)–则收到了计算数据的支持。[19]
这种化学式不应被认为是含有自由离子,而是存在价“空洞”。[19][20]
对Cu(II)盐沉淀的电子顺磁共振研究也显示出溶液中Cu(II)被还原至Cu(I)的过程的存在。[21]
 |  |  |  |  |
参见
- 硫化亚铜, Cu2S
- 靛铜矿
参考
- . 2016-06-24: 4–60. ISBN 1-4987-5428-7 (英语).
- Blachnik, R.; Müller, A., , Thermochimica Acta, 2000, 361 (1–2): 31–52, doi:10.1016/S0040-6031(00)00545-1
- Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0070494398
- Wells A.F. (1962) Structural Inorganic Chemistry 3d edition Oxford University Press
- Greenwood, N. N.; Earnshaw, A. 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- Kuchmii, S.Y.; Korzhak A.V., Raevskaya A.E.,Kryukov A.I. . Theoretical and Experimental Chemistry (New York: Springer). 2001, 37 (1): 36–41. doi:10.1023/A:1010465823376.
- Mane, R.S.; Lokhande C.D. . Materials Chemistry and Physics. June 2000, 65: 1–31. doi:10.1016/S0254-0584(00)00217-0.
- Peiris, M; Sweeney, J.S.; Campbell, A.J.; Heinz D. L. . J. Chem. Phys. 1996, 104: 11–16. doi:10.1063/1.470870.
- Grijalva, H.; Inoue, M.; Boggavarapu, S.; Calvert, P. . J. Mater. Chem. 1996, 6: 1157–1160. doi:10.1039/JM9960601157.
- Oftedal, I. Z. Kristallogr. 1932, 83: 9–25. 缺少或
|title=为空 (帮助) - Berry, L. G. . American Mineralogist. 1954, 39: 504.
- Evans, H.T. Jr.; Konnert J. . American Mineralogist. 1976, 61: 996–1000.
- Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- Magnetic susceptibility of the elements and inorganic compounds 的存檔,存档日期2012-01-12.
- Nakai, I.; Sugitani, Y.; Nagashima, K.; Niwa, Y. . Journal of Inorganic and Nuclear Chemistry. 1978, 40 (5): 789–791. doi:10.1016/0022-1902(78)80152-3.
- Folmer, J.C.W.; Jellinek F. . Journal of the Less Common Metals. 1980, 76 (1-2): 789–791. doi:10.1016/0022-5088(80)90019-3.
- Folmer, J.C.W.; Jellinek F., Calis G.H.M. . Journal of Solid State Chemistry. 1988, 72 (1): 137–144. doi:10.1016/0022-4596(88)90017-5.
- Goh, S.W.; Buckley A.N., Lamb R.N. . Minerals Engineering. 2006年2月, 19 (2): 204–208. doi:10.1016/j.mineng.2005.09.003.
- Liang, W.; Whangbo M, -H. . Solid State Communications. 1993年2月, 85 (5): 405–408. doi:10.1016/0038-1098(93)90689-K.
- Nozaki, H; Shibata, K; Ohhashi,N. . Journal of Solid State Chemistry. 1991年4月, 91 (2): 306–311. doi:10.1016/0022-4596(91)90085-V.
- Luther, GW; Theberge SM, Rozan TF, Rickard D, Rowlands CC, Oldroyd A. . Environ. Sci. Technol. 2002年2月, 36 (3): 394–402. doi:10.1021/es010906k.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.